Esta monografia aprofunda-se no estudo dos agregados plaquetários, como o Plasma Rico em Plaquetas (PRP) e a Fibrina Rica em Plaquetas (PRF), e seu papel fundamental no rejuvenescimento facial. A autora explora a base biológica dessas terapias autólogas, detalhando o mecanismo de ação dos diversos fatores de crescimento liberados pelas plaquetas. O trabalho estabelece um paralelo entre os processos de cicatrização de feridas e a reversão dos sinais do envelhecimento, explicando como esses fatores estimulam a produção de colágeno, a angiogênese e a regeneração celular.
A importância deste conteúdo para o profissional de HOF é imensa, pois ele desmistifica e fundamenta cientificamente o uso de uma das ferramentas mais naturais da medicina regenerativa. A autora também aborda um ponto crítico da área: a falta de padronização nos protocolos de obtenção dos agregados. Portanto, a leitura é essencial para quem busca não apenas aplicar a técnica, mas também compreender as variáveis que influenciam sua eficácia, permitindo uma prática clínica mais crítica, segura e com melhores resultados. Este trabalho foi apresentado por Renata Gonçalves do Lago como Trabalho de Conclusão de Curso (TCC) para a obtenção do título de Especialista em Harmonização Orofacial pelo Instituto Velasco.
Introdução
O envelhecimento da pele é um processo inevitável. Diversos fatores, tanto genéticos como ambientais, afetam a pele. Uma degeneração do tecido conjuntivo e a diminuição em polímeros de ácido hialurônico podem ocorrer devido a fatores intrínsecos e extrínsecos. Há alterações celulares, alterações na matriz extracelular proteica (ECM) dérmica, atrofia dérmica e diminuição dos fibroblastos. A ativação de fibroblastos dérmicos, a remodelagem da ECM e a síntese de colágeno são essenciais para o rejuvenescimento da pele envelhecida. Uma vez que os agregados plaquetários contêm vários fatores de crescimento e várias citocinas, foi colocada a hipótese de que o PRP desempenha um papel na ativação de fibroblastos humanos e na produção de colágeno do tipo I.
Os Fatores de Crescimento aumentam a permeabilidade vascular e ativam a angiogênese, melhorando a vascularização do tecido, que é reduzida com o avanço da idade. Induzem a síntese de colágeno através da estimulação dos fibroblastos. A injeção de PRP permite a entrega direta de Fatores de Crescimento à derme e, se desejado, para a hipoderme. À medida que o estrato córneo é ignorado, a eficácia não depende da penetração transepidérmica dos ativos, como acontece com os Fatores de Crescimento tópicos.
Proposição
O objetivo deste estudo é mostrar a importância dos agregados plaquetários no rejuvenescimento facial, através de pesquisas em artigos científicos recentes, mostrando o seu mecanismo de ação e, mesmo com a falta de padronização de técnicas para obter o PRP ou PRF, podemos alcançar bons resultados.
Revisão da Literatura
Este trabalho foi realizado através de um levantamento em artigos científicos recentes, usando como fontes PubMed, Scielo, Lilacs e o livro “Fibrina rica em plaquetas na odontologia e medicina regenerativa e estética”, editado por Richard J. Miron e Joseph Choukroun, 2018.
A maioria dos artigos pesquisados conclui a eficácia dos agregados plaquetários, auxiliando no rejuvenescimento facial.
Na Itália, Readelli, Romano e Marciano (2010)¹ usaram PRP na revitalização da face e pescoço e observaram melhora na micropigmentação, na textura e na homogeneidade da pele, com redução de pequenas rugas.
Monteiro (2013)² relatou estudos onde a combinação do PRP ao laser fracionado proporcionou rápida recuperação do eritema e edema pós-laser e melhor resultado final na redução de cicatrizes faciais, com superioridade evidente ao método isolado.
No Egito, Mikhael e El-Esawy (2014)³ observaram que o PRP autólogo apresentou porcentagem média de melhora de 58,3% para o rejuvenescimento facial, com boa satisfação na autoavaliação das pacientes.
Yuksel et al. (2014)⁴ avaliaram a firmeza e a flacidez da pele, rugas e problemas de pigmentação. Com 3 aplicações de PRP em intervalos de 2 semanas, demonstrou uma melhora na flacidez e rugas da pele da face e diminuição de cicatrizes.
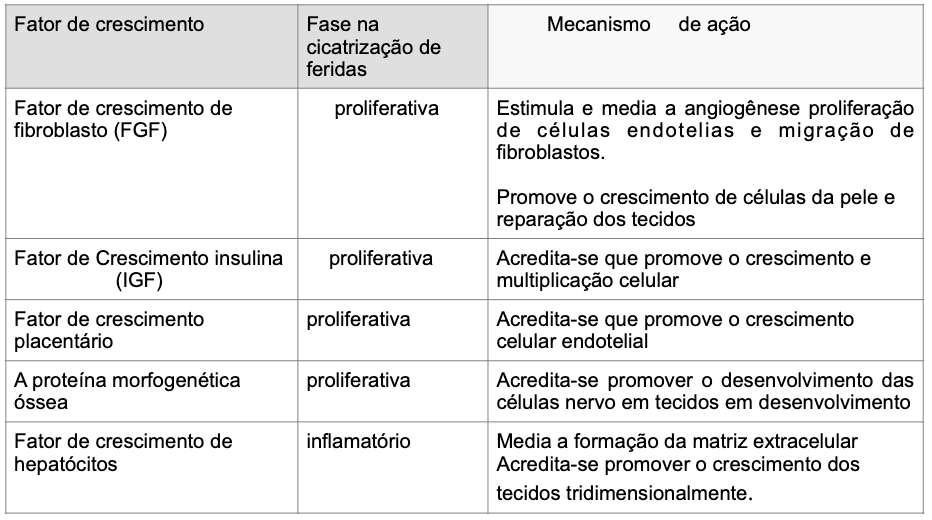
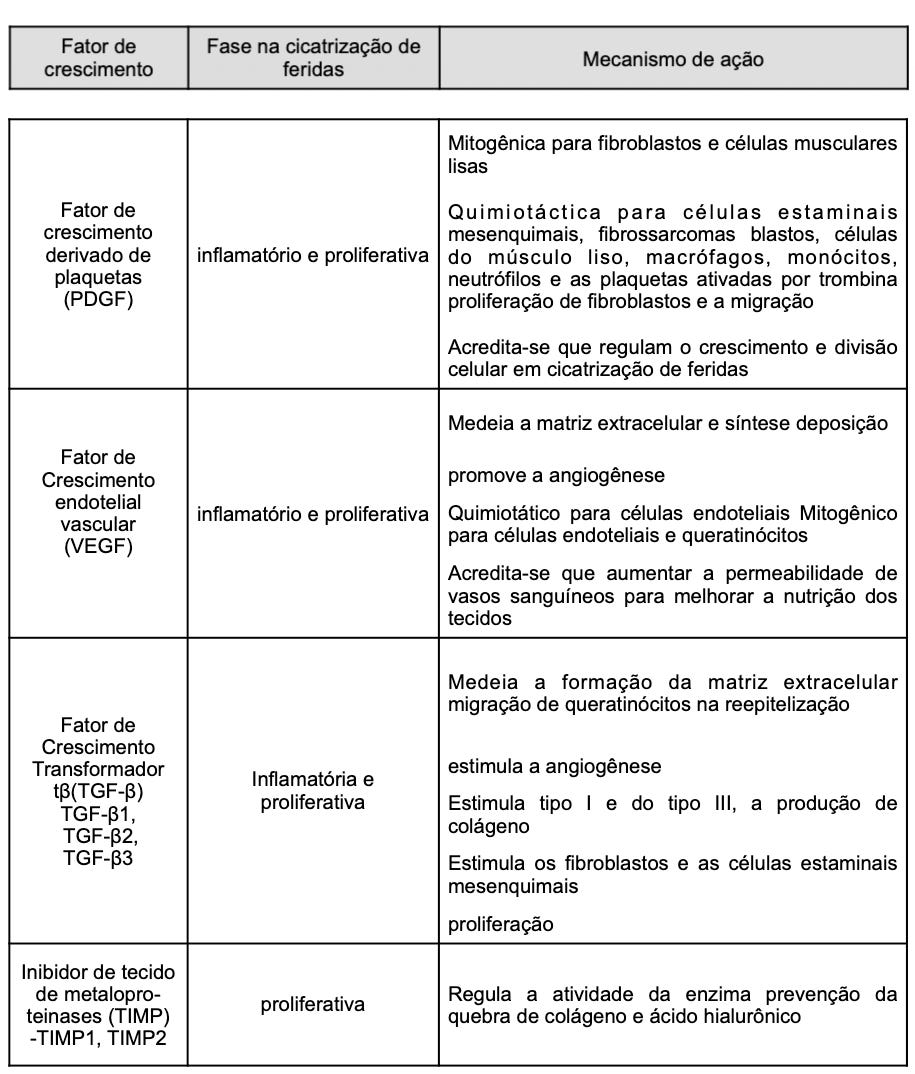
Fabi Sabrina e Sundaram Hema (2014)⁵ explicam em seu artigo a importância de compreender o processo de cicatrização da ferida e a sua ligação com o processo de envelhecimento. Como o conhecimento dos Fatores de Crescimento, tanto injetáveis como tópicos, puderam realizar uma remodelação dérmica, revertendo a colagenase, aumentando a formação de colágeno, estimulando o espessamento epidérmico e diminuindo a inflamação dos tecidos. Compõem um grande grupo de proteínas reguladoras que se ligam aos receptores de superfície celular e servem como mediadores químicos. Por meio dessa interação, eles mediam vias de sinalização celular para controlar o seu crescimento, proliferação e diferenciação. Na pele, eles são sintetizados por fibroblastos, queratinócitos, plaquetas, linfócitos e mastócitos. Os Fatores de Crescimento específicos regulam as atividades celulares vitais, incluindo a mitogênese, angiogênese, quimiotaxia e formação da matriz extracelular (ECM). As tabelas I e II mostram alguns mecanismos de ação que foram identificados para Fatores de Crescimento.
Outro artigo, realizado em 2015 pelos autores Michael S. Leo et al.⁶, utilizando pesquisas de outros autores e 3 aplicações mensais de PRP na face e pescoço, fizeram avaliações por médicos, fotografias de um dermoscópio, câmera digital e sistema de imagem fotográfica. O resultado foi uma melhora de 24% para as rugas nasolabiais, 28% para as rugas horizontais do pescoço, 33% na homogeneidade da pele, 22,5% para a tonicidade da pele e 30% para rugas perioculares. Nesse mesmo artigo, usaram PRP tópico com tratamento de laser e compararam com um grupo que não o utilizou. A biópsia mostrou um aumento na junção dermoepidérmica de 67% e um aumento de 65,4% de fibroblastos. A conclusão é que o PRP beneficia o tratamento estético e de cicatrizes, que possuem um grande potencial quando associado a outras técnicas, como lasers e radiofrequência. Contudo, são necessários mais estudos para controle de técnicas, para melhor compreensão e eficácia do tratamento.
Elghbawi E. et al. (2017)⁷ observaram que o PRP pode produzir um efeito notável sobre a pele, uma vez que estimula a proliferação de fibroblastos dérmicos, melhorando a cor e a textura da pele e diminuindo a profundidade das rugas. Outra capacidade do PRP é estimular a síntese de ácido hialurônico e, por essa razão, é possível contribuir com o rejuvenescimento da pele. O ácido hialurônico melhora a hidratação da pele por ligação e manutenção da capacidade das moléculas de água, que causam inchaço e dão volume e turgidez à pele. Assim, o aumento do nível de ácido hialurônico vai melhorar o aspecto da pele, e o PRP ajuda nesse processo.
Segundo Samadi P., Sheykhhasan M. e Khoshinani H. M. (2018)⁸, à medida que envelhecemos, ocorre uma redução de células na epiderme da face que resulta em flacidez e pele enrugada, principalmente pela baixa produção de colágeno dos fibroblastos. Fatores de crescimento e citocinas são essenciais no processo de regeneração de células da pele; como o PRP tem essas propriedades e outras biologicamente ativas, é uma fonte segura e eficaz para o rejuvenescimento da face. Isso ocorre devido ao aumento da expressão da matriz de metaloproteinase (MMP), que funciona na degradação de componentes da matriz extracelular danificada e faz a remodelação da (ECM), e a uma melhora significativa da proliferação e diferenciação celular. O PRP ainda aumenta a secreção de ácido hialurônico, melhorando a hidratação e a elasticidade da pele.
Miron R. J. e Choukroun J. (2018)⁹ descrevem que, ao pensarem em regeneração tecidual, quatro aspectos são importantes para a cicatrização das feridas: hemostasia, inflamação, proliferação e maturação. As fases desses processos se sobrepõem, e cada fase envolve diversos tipos celulares. Eles indicam as proteínas do sangue humano como fonte de fatores de crescimento capazes de sustentar a angiogênese e a invaginação tecidual. As plaquetas são relatadas como o componente responsável pela ativação e liberação de fatores de crescimento cruciais, incluindo o fator de crescimento derivado de plaquetas (PDGF), o fator de crescimento endotelial vascular (VEGF), fatores de coagulação, moléculas de adesão, citocinas/quimiocinas e uma variedade de outros fatores angiogênicos, que possibilitam o recrutamento e a atividade de fibroblastos, leucócitos, macrófagos e células-tronco mesenquimais (MSC). Também têm sido descritas como um componente-chave na fase inicial de regeneração tecidual e são importantes na hemostasia e na formação do coágulo de fibrina. Os fibroblastos começam a produzir colágeno aleatoriamente e, assim, a angiogênese ocorre ao mesmo tempo em que a ferida começa gradualmente a ganhar estabilidade inicial. Na fase final de remodelação, o colágeno é substituído pelas fibrilas colágenas organizadas que dão resistência melhorada ao local danificado.
Murad et al. (2018)¹⁰ realizaram um ensaio clínico para comparar a eficácia do PRP. Então, selecionaram 27 pacientes e aplicaram 3 ml de injeções de PRP em um dos lados da bochecha e, no outro lado, uma solução de soro estéril, não deixando os pacientes saberem qual o lado em que cada produto foi aplicado. Em uma única aplicação, os resultados foram avaliados em 2 semanas, 3 meses e 6 meses. A maioria dos pacientes observou melhora no lado em que o PRP foi aplicado, e a conclusão desse artigo foi que, pelo menos temporariamente, ocorreram melhoras na aparência visual da pele fotoenvelhecida.
Z-Hye Lee et al. (2018)¹¹ também realizaram aplicações de PRP em 31 pacientes, em 6 pontos em cada lado da face. Concluíram que os resultados mostram que, mesmo com um método simplificado de preparação de PRP, 14 pacientes ficaram satisfeitos com o resultado. Aplicações para o envelhecimento da pele facial têm resultados mínimos, e várias sessões são consideradas necessárias para um benefício duradouro. Estudos futuros devem basear-se nos resultados deste ensaio, alterando seletivamente os métodos de preparação e aplicação. Os resultados devem ser avaliados utilizando ambas as medidas de resultados objetivos e avaliações relatadas pelos pacientes. Com esses passos, a eficácia clínica do PRP para os tratamentos do envelhecimento da pele facial pode ser restabelecida e, com isso, otimizar melhores resultados.
Peter A. Everts, Pedro Contreiras Pinto e Leonor Girão (2018)¹² aplicaram 3 injeções mensais em 11 pacientes e observaram melhoras nas manchas acastanhadas, mudanças e melhoras nas áreas do sulco nasolabial e firmeza da pele na região malar. Eles concluíram que o PRP teve um impacto reprodutível e positivo significativo sobre o rejuvenescimento facial biológico, o que foi confirmado por avaliações do paciente.
Quando os pesquisadores Cho E. B., Park G. S., Park S. S. et al. (2018)¹³ estudaram os efeitos do PRP na proliferação e migração de fibroblastos, já sabiam que o colágeno constitui a maioria das estruturas fibrosas, proporcionando assim resistência à tração do tecido, e que o componente de colágeno mais proeminente da derme é o colágeno tipo I. Enzimas como as metaloproteinases de matriz (MMPs), que degradam as proteínas da matriz dérmica, são produzidas por fibroblastos dérmicos e queratinócitos epidérmicos. Existem vários tipos diferentes de MMPs, e cada um é capaz de quebrar diferentes proteínas. Especificamente, a degradação do colágeno tipo I é principalmente mediada por MMP-1 (colagenase) e MMP-2 (gelatinase). O plasma rico em plaquetas ativa os fibroblastos através de vários fatores de crescimento intrínsecos, sintetiza o colágeno e outros componentes da membrana extracelular (ECM) e vários fatores de crescimento que contribuem para o processo de cicatrização da ferida. Portanto, espera-se que o mecanismo do PRP esteja associado a diferentes vias de sinalização intracelular. Este estudo buscou confirmar a proliferação e migração de fibroblastos (HDFs) tratados com PRP, além da expressão de colágeno, elastina, MMP-1 e MMP-2. Os fibroblastos ativados podem induzir a reconstituição do ambiente fisiológico ideal e melhorar a atividade celular, a hidratação e a síntese de colágeno, elastina e ácido hialurônico (HA). Os fibroblastos na pele envelhecida têm uma capacidade marcadamente reduzida para produzir nova elastina. A integridade estrutural da ECM é melhorada pelo colágeno recentemente sintetizado. Neste estudo, confirmaram não apenas os níveis aumentados de colágeno e elastina — que são componentes da ECM —, mas também a expressão de MMP-1 e MMP-2 em fibroblastos tratados com PRP. A partir desses resultados, eles confirmaram o PRP como um mecanismo terapêutico antienvelhecimento e, pela primeira vez, o papel e a importância direta da elastina em manter a maciez da pele e do fibroblasto em dar elasticidade para a pele, contribuindo assim no rejuvenescimento.
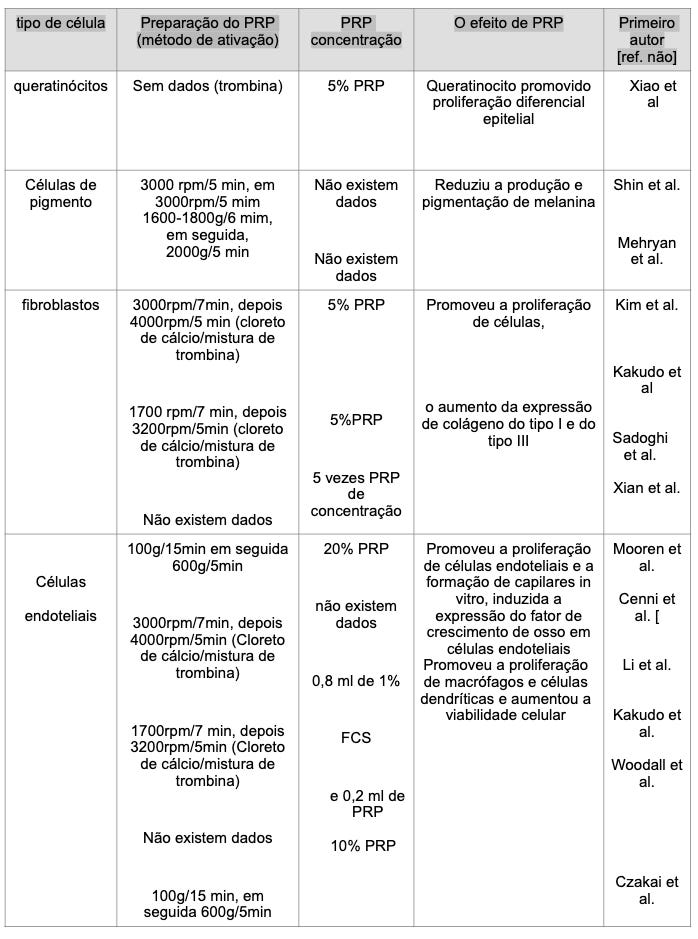
Xiaoxuan Lei, Pengcheng Xu e Biao Cheng (2018)¹⁴ fizeram uma revisão sistemática com 108 artigos sobre o PRP e concluíram que os numerosos fatores de crescimento no PRP podem apresentar efeitos observados em rejuvenescimento facial. O PDGF recruta macrófagos e fibroblastos e estimula os macrófagos a segregarem fatores de crescimento, tais como o TGF-β. Através de tabelas, eles divulgaram as pesquisas de artigos dos autores pesquisados. Na sequência, irei reproduzir as tabelas III e IV.
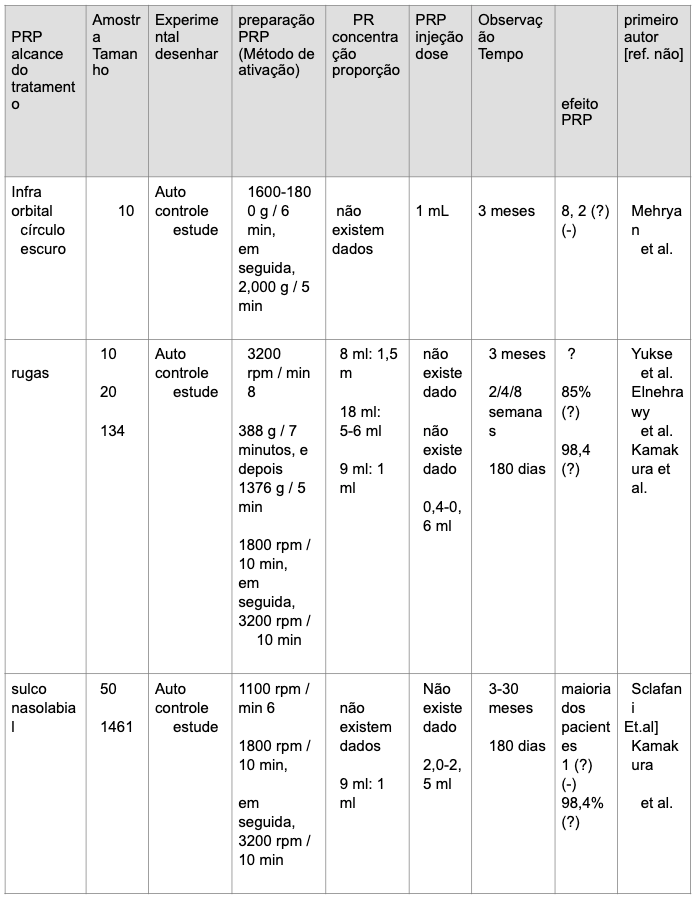
Discussão
Os métodos existentes na literatura não alcançam as mesmas concentrações plaquetárias, sendo algumas insuficientes para melhorar a cicatrização. Estes fatores podem justificar muito do criticismo a respeito da eficácia do plasma rico em plaquetas. Em encontros específicos sobre o assunto na área da Saúde, foram divulgados os benefícios e métodos aparentemente simples de preparo do plasma rico em plaquetas. Isto levou muitos profissionais a anotar a velocidade e o tempo de centrifugação do sangue para venderem seus serviços, banalizando seu preparo. Assim, produtos com baixa qualidade foram utilizados, sem alcançar os benefícios pretendidos. É fácil centrifugar um sangue, juntar o plasma com plaquetas ao cálcio e obter um gel. Porém, qual a quantidade de plaquetas presente? Ou seja, qual a qualidade deste gel de plasma rico em plaquetas? Além disto, alguns métodos parecem ser pouco reprodutíveis.
Há vários protocolos de centrifugação que concentram e capturam as plaquetas visando a obtenção do PRP. Estes diferem em número, tempo e velocidades de centrifugação a que o sangue total é submetido, volume da amostra inicial de sangue e os tipos de tubos coletores e anticoagulantes utilizados (Monteiro, 2013)² . Em geral, a técnica consiste em submeter o sangue coletado com anticoagulante EDTA ou Citrato de Sódio a uma centrifugação que separa e concentra os eritrócitos, obtendo-se três camadas distintas de acordo com a densidade. A camada inferior (densidade 1,09) é composta por células vermelhas; a camada média (densidade 1,06) é composta por glóbulos brancos e plaquetas; e a camada superior (densidade 1,03) é composta por plasma pobre em plaquetas (PPP). Algumas técnicas simplesmente separam a camada superior das demais, obtendo um plasma rico em plaquetas; enquanto em outros métodos, retira-se a camada superior e a retorna a outro tubo para centrifugação para a separação precisa do PRP dos eritrócitos restantes, cuidando para evitar a fragmentação das plaquetas durante o processo, o que poderia causar sua ativação precoce. Em seguida, a fração sobrenadante, que é rica em plaquetas, é coletada e transferida para outro tubo, onde na maioria dos métodos é realizada a ativação plaquetária com cloreto ou gluconato de cálcio a 10%. Algumas vezes, acrescenta-se trombina (Fabi; Sundaram, 2014)⁵; (Mikhael; El-Esawy, 2014)³.
Tanto o PRP como o PRF contêm muitas plaquetas, e modificações no tempo e processo de centrifugação aumentam o número de macrófagos, leucócitos e um grande número de fatores de crescimento: fator de crescimento transformador-β1 (TGF-β1), o fator de crescimento derivado de plaquetas (PDGF), o fator de crescimento endotelial vascular (VEGF) e o fator de crescimento semelhante à insulina-1 (IGF-1), capazes de promover a migração, proliferação e diferenciação celular de maneira totalmente biológica e natural.
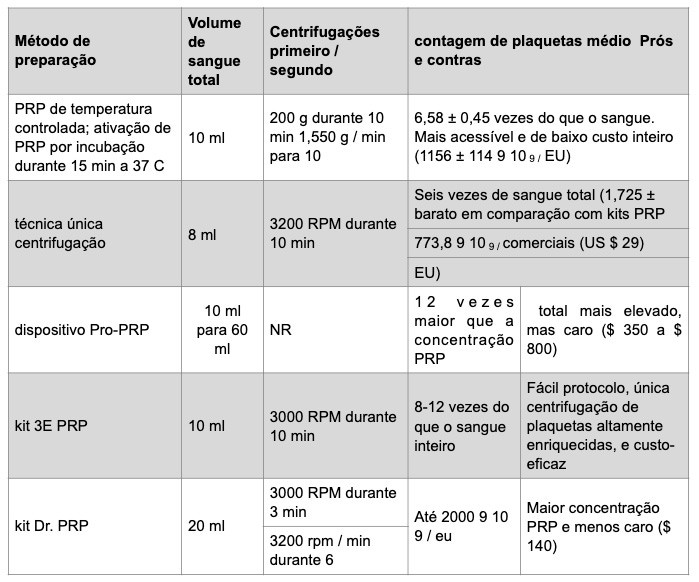
Segundo Vendramin FS, Franco D e Franco TR (2009)¹⁵, três variáveis importantes que influenciam na qualidade do plasma rico em plaquetas são: força de centrifugação, tempo de centrifugação e redução do volume plasmático. Por isso, estudaram-se estas variáveis para definir o método que alcança maiores concentrações de plaquetas, sem prolongar muito o tempo de preparo do produto e conseguindo volumes finais de plasma rico em plaquetas que pudessem ser previstos antes do procedimento. A força de centrifugação, que é um fator importante para a separação dos componentes sanguíneos devido à sua densidade específica, depende da velocidade de centrifugação e do raio da centrífuga e tem como unidade de medida a força da gravidade (g). Por isso, trabalhos que relatam apenas a velocidade de centrifugação, sem mencionar a centrífuga utilizada ou seu raio, fornecem informações incompletas para a reprodução da metodologia. Realizaram 63 testes por meio de centrifugação para saber qual produziria mais plaquetas. A força de centrifugação que mais concentrou plaquetas no seu experimento foi de 400 g na primeira centrifugação e 800 g na segunda, alcançando um aumento em média de 438%. Ao aumentarmos o tempo da segunda centrifugação de 10 para 15 minutos, houve menor aumento na concentração plaquetária (de 438% para 397%), mas sem significância estatística, levando à conclusão de que os valores são similares. Porém, o tempo de preparo do produto deve ser o menor possível, uma vez que é preparado imediatamente antes da cirurgia, ou até mesmo enquanto a cirurgia se inicia. Por isso, adotaram no protocolo o tempo de 10 minutos em cada centrifugação. A preparação por meio de duas centrifugações, sendo a primeira a 400 g por 10 minutos e a segunda a 800 g por 10 minutos, com redução de 90% do plasma, obtém um plasma rico em plaquetas com aumento, em média, de 570% na concentração plaquetária em relação ao sangue. Comparou seu resultado com outros autores (tabela V).
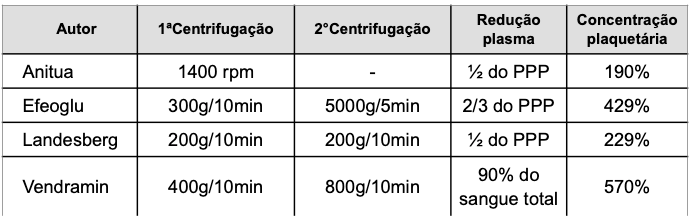
Landesberg et al. (2000)¹⁶ relataram aumento da concentração plaquetária com o aumento da força de centrifugação até 200 g. Após este valor, ocorreu diminuição na concentração plaquetária de 205,7% para 185% ao aumentar a força de centrifugação de 200 g para 250 g. Contrariamente a isso, o aumento da força de centrifugação sempre levou ao aumento na concentração plaquetária. Porém, quando utilizamos uma força de 1600 g, muitos tubos quebraram durante o processo de centrifugação e abandonamos esta técnica.
Cho EB, Park GS, Park SS et al. (2018)¹³ utilizaram um Kit de Bio PROSYS (PRODIXEN Inc, República da Coreia). O sangue é colhido em tubos com anticoagulantes e submetido a 2 centrifugações: a primeira por 3 minutos a 1200 x g e a segunda por 3 minutos a 1500 x g.
Samadi P., Sheykhhasan M. e Khoshinani H. M. (2018)⁸ fizeram uma tabela, reproduzida logo abaixo (tabela VI), para mostrar diferentes métodos para realizar o PRP.
Embora a maioria dos artigos relate bons efeitos clínicos dos agregados plaquetários para fins estéticos, alguns não acharam os efeitos do PRP tão significativos. Porém, nenhum artigo deixou de mostrar algum resultado clínico. A falta de padronização do PRP foi relatada em todos os artigos como um fator relevante nos tratamentos. Ainda não chegaram à conclusão de qual seria o melhor protocolo de centrifugação e tratamento. Esse fato também dificulta a avaliação dos reais benefícios do PRP. Há muitos fatores que poderiam influenciar a eficácia do PRP, por exemplo, a força de centrifugação, o método da ativação, a idade do doador, alimentação, sexo, o número de plaquetas e se o PRP contém glóbulos brancos. O número de injeções aplicadas e os intervalos entre elas também podem afetar o resultado final do tratamento.
Os artigos mais recentes conseguiram mostrar que o PRP consegue ativar os fibroblastos para a produção de colágeno tipo I, além de os fatores de crescimento contribuírem com a cicatrização. Por ser um produto natural, tem baixo risco, e sua disponibilidade e utilização são fáceis. A cada ano, aumentam o uso do PRP para fins estéticos e surgem maiores evidências de sua eficácia.
Conclusão
Os agregados plaquetários possuem grandes variedades de proteínas e fatores de crescimento que podem ajudar no rejuvenescimento facial, melhorando muito a síntese de colágeno e alcançando bons resultados. Ajudam a reverter o processo natural de envelhecimento. Embora seu uso ainda seja considerado recente e sem padronização, muitas pesquisas estão sendo feitas para comprovar os seus benefícios e os ganhos quando aplicados junto com outros tratamentos estéticos faciais.
Abreviaturas
Ácido Hialurônico (HÁ)
Matriz Extracelular Proteica (ECM)
PRP (Plasma Rico em Plaquetas)
Fatores de Crescimento (GFs)
PRF (Plasma Rico em Fibrina)
Fator de crescimento derivado de plaquetas (PDGF)
Fator de Crescimento endotelial vascular (VEGF)
Fator de Crescimento Transformador tβ (TGF-β), TGF-β1, TGF-β2, TGF-β3
Inibidor de tecido de metaloproteinases (TIMP) - TIMP1, TIMP2
Fator de crescimento de fibroblasto (FGF)
Fator de crescimento semelhante à insulina (IGF)
Matriz de Proteínas Metaloproteinase (MMP)
Células-tronco Mesenquimais (MSC)
Proliferação e Migração de Fibroblasto (HDFs)
EDTA (ácido etilenodiamino tetra-acético)
Plasma Pobre em Plaquetas (PPP)
Referências Bibliográficas
READELLI, A.; ROMANO, D.; MARCIANO, A. Face and neck revitalization with Platelet-rich Plasma (PRP): clinical outcome in a series of 23 consecutively treated patients. Journal of Drugs in Dermatology, v. 9, n. 5, p. 466-472, 2010.
MONTEIRO, M. R. Platelet-rich plasma in dermatology. Surgical & Cosmetic Dermatology, v. 5, n. 2, p. 155-159, 2013.
MIKHAEL, N. W.; EL-ESAWY, F. M. Skin rejuvenation with autologous concentrated platelet-rich plasma. Egyptian Journal of Dermatology and Venereology, v. 34, p. 5-9, 2014.
YUKSEL, P. E. et al. Evaluation of effects of platelet-rich plasma on human facial skin. Journal of Cosmetic and Laser Therapy, v. 16, p. 206-208, 2014.
FABI, S.; SUNDARAM, H. The Potential of Topical and Injectable Growth Factors and Cytokines for Skin Rejuvenation. Facial Plastic Surgery, v. 30, n. 2, p. 157–17, 2014.
LEO, M. S. et al. Systematic review of use of platelet-rich plasma in aesthetic dermatology. Journal of Cosmetic Dermatology, v. 4, p. 315-323, 2015.
ELNEHRAWY, N. Y. et al. Avaliação da eficácia e segurança de injeção de plasma rico em plaquetas única em diferentes tipos e graus de rugas faciais. Cosmet J Dermatol, v. 16, p. 103-111, 2017.
SAMADI, P.; SHEYKHHASAN, M.; KHOSHINANI, H. M. The Use of Platelet-Rich Plasma in Aesthetic and Regenerative Medicine: A Comprehensive Review. Aesthetic Plastic Surgery, publicado online; dez. 2018.
MIRON, R. J.; CHOUKROUN, J. Platelet rich fibrin in regenerative dentistry: biological background and clinical indications. Quintessence editora Ltda, 1ª edição, 2018.
ALAM, M. et al. Effect of platelet-rich plasma injection for rejuvenation of photoaged facial skin randomized clinical trial. American Medical Association, publicado online nov. 2018.
LEE, H. et al. Platelet rich plasma for photodamaged skin: A pilot study. Jornal Cosmet Dermatol, v. 00, p. 1-7, 2018.
EVERTS, P. A.; PINTO, P. C.; GIRÃO, L. Autologous pure platelet-rich plasma injections for facial skin rejuvenation: Biometric instrumental evaluations and patient-reported outcomes to support anti-aging effects. Jornal Cosmet Dermatal, v. 00, p. 1-11, 2018.
CHO, E. B. et al. Effect of platelet-rich plasma on proliferation and migration in human dermal fibroblasts. Jornal Cosmet Dermatol, v. 00, p. 1-8, 2018.
LEI, X.; XU, P.; CHENG, B. Problems and Solutions for Platelet-Rich Plasma in Facial Rejuvenation: A Systematic Review. Aesth Plast Surg, publicado online; out 2018.
LANDESBERG, R.; ROY, M.; GLICKMAN, R. S. Quantification of growth factor levels using a simplified method of platelet-rich plasma gel preparation. J Oral Maxillofac Surg, v. 58, n. 3, p. 297-300, 2000.
VENDRAMIN, F. S.; FRANCO, D.; FRANCO, T. R. Methods to obtain autologous platelet-rich plasma gel. Rev Bras Cir Plast, v. 24, n. 2, p. 212-218, 2009.