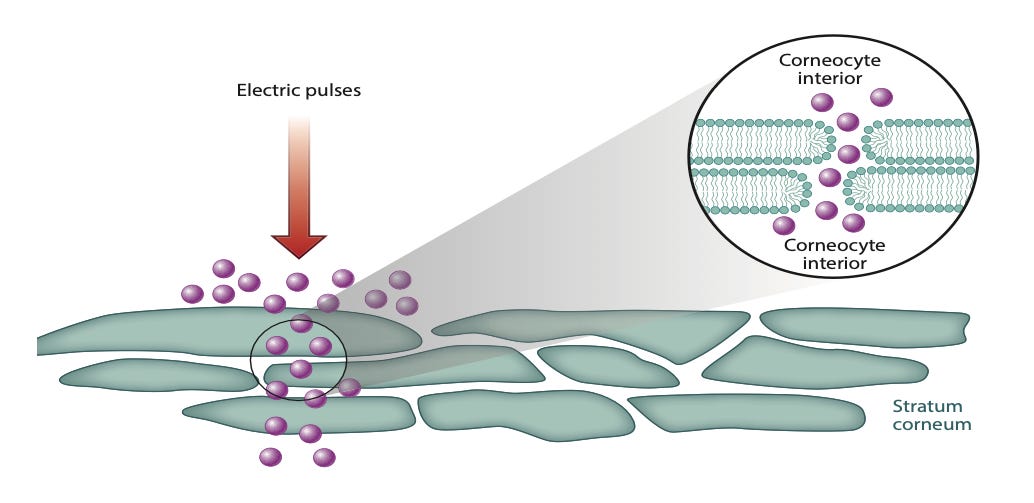
A busca por métodos mais eficientes e menos invasivos para a administração de fármacos através da pele é um dos campos mais desejados da ciência farmacêutica e da medicina estética. A principal barreira, o estrato córneo, desafia a entrega de moléculas maiores e hidrofílicas, limitando o potencial de muitos tratamentos. Como superar essa barreira de forma segura e eficaz?
Uma das respostas para essa questão é a eletroporação, uma técnica que utiliza pulsos elétricos controlados para aumentar temporariamente a permeabilidade da pele. Este método abre novas fronteiras para a aplicação de ativos que antes eram restritos a vias de administração mais invasivas.
O trabalho que você lerá a seguir, de autoria da Dra. Kristine Soldatelli, explora este tema interessante. Realizado como requisito para a obtenção do título de Especialista em Harmonização Orofacial pelo Instituto Velasco, este trabalho oferece uma revisão criteriosa sobre o aumento da permeação cutânea, com foco especial na técnica de eletroporação.
INTRODUÇÃO
O aumento do potencial do uso da rota transdérmica de fármacos tem sido de grande procura na indústria farmacêutica e na área médica. É uma alternativa útil às vias convencionais de administração, como as vias oral ou injetável. Evita a degradação no trato gastrointestinal e o metabolismo hepático de primeira passagem. A via transdérmica permite uma administração controlada constante ou variável no tempo e melhora a adesão do paciente ao tratamento. Além, é claro, de ser um ramo extremamente lucrativo. O mercado mundial de substâncias transdérmicas foi avaliado em US$ 2 bilhões no ano 2000 e representa o mais bem sucedido sistema de entrega de medicamentos não orais (4). Em 2005 o investimento nesta área especializada foi em torno de U$ 13 bilhões com previsão de crescimento para U$ 22 bilhões em 2010. Em 2015 o valor alcançou U$32 bilhões (2). O modo transdérmico apresenta muitas vantagens distintas, como por exemplo, uma extensa área acessível (1-2m²) para absorção.
No entanto, pouquíssimos medicamentos podem ser administrados por esta via devido à baixa permeabilidade da pele. Para moléculas carregadas ou polares e macromoléculas, a distribuição de quantidades terapêuticas através da pele é difícil. Por essa razão, as aplicações práticas ainda permanecem limitadas a uma gama estreita de fármacos, devido à camada de barreira da pele, o estrato córneo (EC), que proporciona uma baixa permeabilidade a moléculas exógenas. Abordagens químicas e físicas para aumentar o transporte transdérmico têm sido exploradas para potencializar a permeabilidade da pele e expandir a gama de medicamentos que podem ser administrados por via transdérmica. Entre os meios químicos para otimizar a permeação passiva dos ativos encontram-se: manipulação das formulações, microemulsões, sistemas lipossomais e soluções supersaturadas. E nos sistemas de entrega utilizando propriedades físicas que intensificam a permeação, métodos como ultrassom, lasers, microagulhamento e campos elétricos, tais como iontoforese e a eletroporação [cite: 3-6].
Este estudo abrange uma propriedade física, a eletroporação, para aumentar o transporte transdérmico. A iontoforese será descrita brevemente, pois também faz uso de aplicações de correntes elétricas, podendo gerar dúvidas ao leitor sobre as duas técnicas.
OBJETIVO
O presente estudo tem por objetivo apresentar a técnica de eletroporação como um meio possível de aumentar a permeação de ativos de alto peso molecular e hidrofílicos.
REVISÃO DE LITERATURA
A Pele – Estrato Córneo
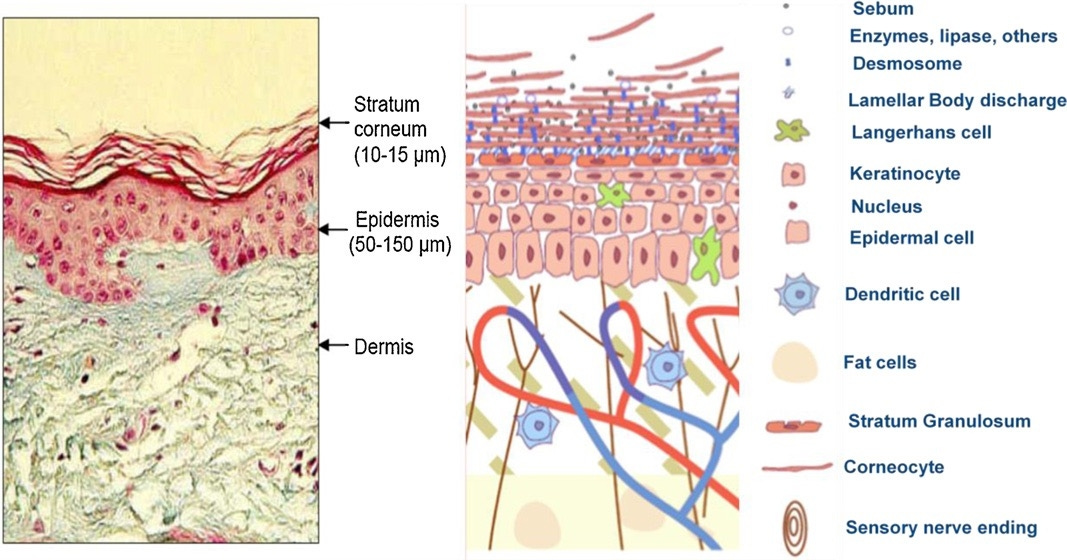
Por mais de 150 anos, a estrutura da pele e sua função têm sido assunto de muita investigação dos cientistas. O estrato córneo é uma membrana extraordinária. Sua função barreira previne a entrada de diversos patógenos como poluentes, vírus, bactérias e espectro da radiação solar, sendo vital para a homeostase da temperatura corpórea, eletrólitos e equilíbrio de fluidos. Evita também a perda de água transepidermal. Da mesma forma, o estrato córneo não permite a entrada de maneira passiva de moléculas com alto peso molecular, polares e hidrofílicas.
O estrato córneo tem uma organização estrutural de dois compartimentos muito simples ao nível microscópico óptico, com os corneócitos embutidos em uma matriz lipídica. Isso levou à sua comparação com um “sistema de tijolo e argamassa” (Figura 1) originalmente descrito por Michaels et al. 1975. No nível ultraestrutural, tanto os tijolos quanto os componentes de argamassa do EC têm uma incrível complexidade estrutural e funcional, adaptações metabólicas e capacidade de automanutenção por renovação constante.
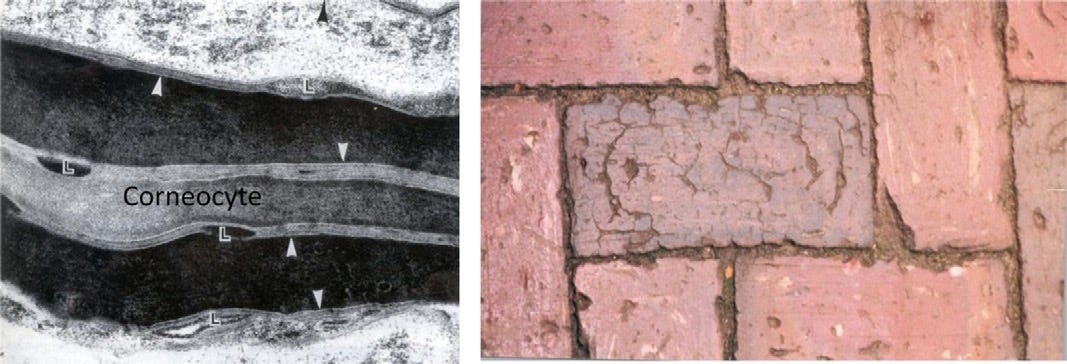
a) Os corneócitos: Células sobrepostas entre 18-20 camadas dependendo da localização anatômica no corpo; estes fornecem a barreira física.
b) Corneodesmossomos: funcionam como “soldas a ponto” ou “rebites” para manter os corneócitos juntos. Os desmossomos são programados para passar por um processo de degradação gradual, de modo a permitir a descamação ordenada dos corneócitos mais externos e desgastados.
c) Os lipídios da “argamassa” preenchendo o caminho tortuoso entre os corneócitos sobrepostos: uma mistura altamente complexa com cerca de 13 espécies de ceramidas, colesterol e ácidos graxos livres em proporção equimolar; estes fornecem a barreira de permeabilidade.
d) Uma bateria de enzimas lipolíticas e proteolíticas: envolvidas no processamento de lipídios pró-barreira e degradação de desmossomos, respectivamente, contribuem para atividades bioquímicas contínuas no estrato córneo, que antes se pensava estar inerte e morto.
e) O conteúdo secretado dos corpos lamelares epidérmicos na interface do estrato córneo e do estrato granuloso: são os lipídios pró-barreira que dão origem às múltiplas lamelas lipídicas do EC e que se intercalam com as enzimas e peptídeos antimicrobianos.
Os principais componentes estruturais deste sistema composto podem ser representados pelo desenho esquemático da pele (Figura 2).
Todos esses componentes são cruciais para a barreira do estrato córneo, que é visto como um desafio para a administração transdérmica de drogas. Interferir ou alterar as propriedades funcionais de qualquer um desses componentes pode enfraquecer a função barreira. Superar a propriedade notável da barreira da pele de uma maneira temporal, eficaz e segura ao mesmo tempo tem sido um desafio constante para a indústria farmacêutica e para a medicina. Abordagens químicas e físicas para aumentar o transporte transdérmico têm sido exploradas para potencializar a permeabilidade da pele e expandir a gama de medicamentos que podem ser administrados por via transdérmica (Figura 3).
Base da Função de Barreira de Membrana de Bicamada Celular
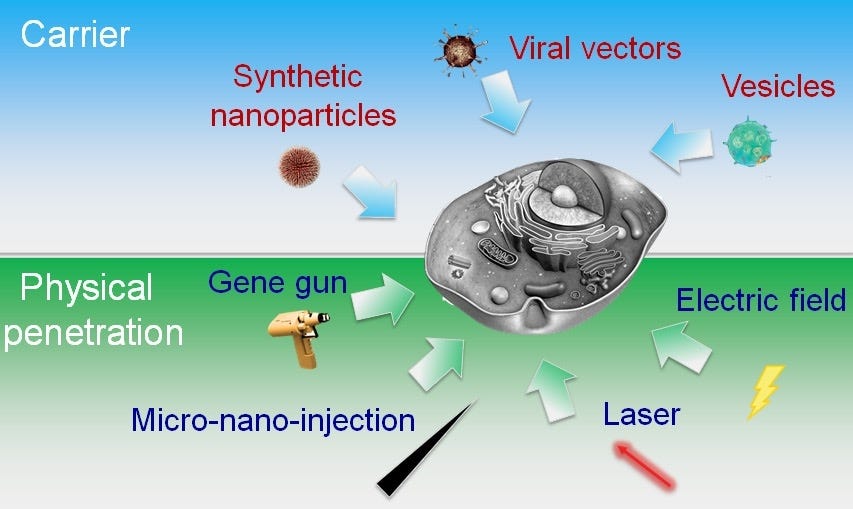
É amplamente conhecido que as células possuem membranas para separar os compartimentos extra e intracelular. Algumas moléculas utilizadas pelas células possuem mecanismos específicos de transporte transmembrana. Isso ocorre através de um meio de transporte relativamente inespecífico que é conhecido por permeação difusa. Algumas partes da membrana possuem complexos proteicos que são facilitadores do transporte de substâncias (canais e bombas iônicas). Essas estruturas podem funcionar por difusão (canais iônicos) ou serem comandadas por sinais elétricos ou químicos com uso de energia (bombas iônicas). A troca de substâncias é necessária para garantir a homeostase celular. A Figura 4 representa a organização da membrana celular.
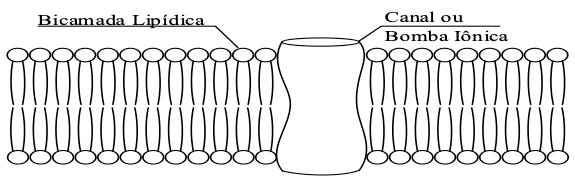
A diferença de potencial elétrico entre o lado interno e externo de sua membrana plasmática, gerada e regulada por um sistema de bombas iônicas e canais na membrana, é denominada voltagem transmembrana de repouso (TMV). Em células eucarióticas, o TMV de repouso normalmente varia de –40 a −70 mV, no sentido de que o potencial interno é menor que o externo. Como este é o estado natural das membranas biológicas, tanto seus componentes lipídicos quanto proteicos são evolutivamente bem adaptados e funcionam sob voltagens nesta faixa.
Correlação entre Tensão Transmembrana e Eletroporação:
A exposição de uma célula a um campo elétrico externo resulta em um componente adicional de TMV, denominado TMV induzido, sustentado pela duração da exposição e proporcional à força do campo elétrico externo. Assim, exposições a campos suficientemente fortes podem induzir TMVs excedendo significativamente sua faixa de repouso e causando tanto mudanças estruturais na membrana quanto mudanças em suas moléculas constituintes que não ocorrem em condições fisiológicas.
Correlação entre Tensão Transmembrana e Transporte Mediado por Eletroporação:
Entre os efeitos mais claros e proeminentes está a eletropermeabilização/eletroporação da membrana. Um aumento rápido e substancial na permeabilidade da membrana, revelado pelo transporte transmembranar de moléculas para as quais uma membrana intacta é praticamente impermeável. Vários estudos, baseados em considerações experimentais e teóricas, implicaram que o fluxo molecular através da membrana eletropermeabilizada é amplamente limitado às regiões da membrana expostas a TMV suficientemente alto. Isso foi conclusivamente demonstrado experimentalmente, para uma única célula, bem como grupos de células, monitorando tanto o TMV quanto o transporte transmembrana nas mesmas células após sua exposição a pulsos elétricos.
Base de Meios Físicos que Aumentam a Permeabilidade Cutânea Através de Correntes Elétricas
Iontoforese
A iontoforese permite a entrada de drogas ionizadas e não ionizadas com baixo perfil de permeação através da membrana celular. Consiste na aplicação de uma corrente elétrica de baixa intensidade (0,5 mA/cm² ou inferior) e baixa voltagem (<100V), de forma pulsátil ou contínua e por longo período. Isto promove o movimento de fármacos através das membranas biológicas. A magnitude da corrente determina a quantidade de energia gerada no circuito e, em troca, um determinado número de íons são transportados pela pele. A quantidade de íons transpassados é proporcional à quantidade de carga utilizada. O tempo estendido da aplicação da corrente elétrica promove o aquecimento do local, causando assim um efeito térmico sobre o tecido. A aplicação é indicada para drogas com um limite de peso molecular de 20 kDa.
Assim, a iontoforese proporciona uma força motriz eletroquímica para o transporte de fármacos através da pele, em vez de aumentar a sua permeabilidade pela alteração da sua estrutura (Figura 5). Como tal, aplica-se geralmente a moléculas carregadas e algumas macromoléculas com peso molecular até 15 kDa. Existem dois mecanismos principais para o transporte das moléculas através desta técnica, sendo o mais comum designado por eletrorrepulsão, baseando-se no princípio de que cargas iguais se repelem. Consiste na repulsão de moléculas de fármaco carregadas por um eletrodo com a mesma polaridade, que as força a entrar na pele. O outro mecanismo denomina-se eletro-osmose e origina um fluxo de solvente do ânodo para o cátodo, devido à aplicação de corrente elétrica na pele (membrana carregada negativamente), e que se aplica à difusão de moléculas neutras. Uma vantagem desta técnica reside no fato de que a velocidade de liberação do fármaco é dependente da corrente aplicada.
Eletroporação
A eletroporação (EP) é o fenômeno de aumento da permeabilidade da membrana celular (dupla camada lipídica) quando a célula é exposta a campos elétricos de amplitude acima de dezenas de kV/m e duração de nanossegundos a segundos. O aumento da permeabilidade é explicado pela formação de poros na membrana celular. Dependendo da configuração do protocolo aplicado, a membrana plasmática pode se fechar, caracterizando a eletroporação reversível, ou não se recuperar, causando um processo irreversível levando à morte celular.
HISTÓRIA DA ELETROPORAÇÃO
De acordo com os pesquisadores Ivorra e Rubinsky, o provável primeiro registro de eletroporação ocorreu em 1754, quando Nollet percebeu e registrou a formação de marcações vermelhas na pele de humanos e animais em áreas onde eram aplicados centelhamentos elétricos. Ao longo dos próximos dois séculos, Ritter em 1802, Frankenhaeuser & Widén em 1956, e Stampfli & Willi em 1957 relataram que a eletroporação da membrana nervosa pode explicar as mudanças de condutividade elétrica nos nervos que foram danificados por campos elétricos. A aplicação médica da eletroporação começou em 1982 com o trabalho inspirador de Neumann e colaboradores. Esses autores usaram campos elétricos pulsados para permeabilizar temporariamente as membranas celulares para entregar DNA estranho nas células. Na década seguinte, a combinação de campos elétricos pulsados de alta voltagem com o quimioterápico bleomicina e com DNA rendeu novas aplicações clínicas: eletroquimioterapia e eletrotransferência, respectivamente. Nos últimos anos, a eletroporação irreversível não térmica (NTIRE) para ablação de tumores sólidos surgiu como uma nova aplicação médica da tecnologia de eletroporação.
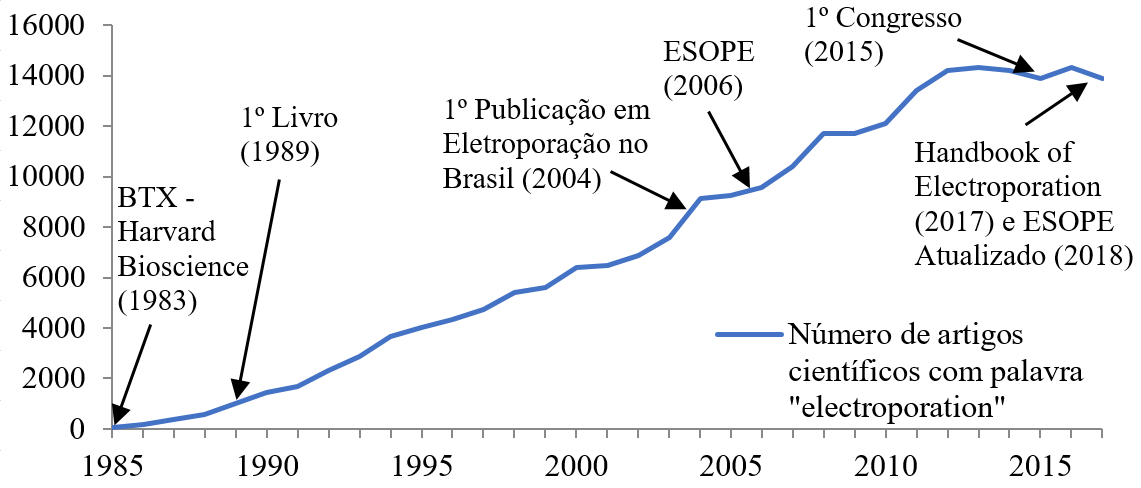
Segundo Pintarelli, atualmente, a eletroporação é um tópico de pesquisa consolidado e de crescente interesse, como pode ser percebido pelo acréscimo no número de publicações que citam o tema. O número de aparições da palavra “electroporation” em artigos científicos entre 1985 e 2017 é disponível na Figura 6. Na Figura 6 também são indicados alguns eventos importantes em eletroporação, são esses:
Em 1983: criação da empresa BTX do grupo Harvard Bioscience. Esta foi a primeira empresa a vender eletroporador comercial para transferência genética;
Em 1989: primeiro livro sobre eletroporação (JORDAN; NEUMANN; SOWERS, 1989);
Em 2004: primeiro trabalho no Brasil em eletroporação pelos pesquisadores Airton Ramos e Daniela O. H. Suzuki (RAMOS; SUZUKI; MARQUES, 2004);
Em 2006: criação da padronização para tratamento de câncer por eletroquimioterapia (ESOPE, “Standard Operating Procedures Of The Electrochemotherapy”) (MIR et al., 2006);
Em 2015: primeiro congresso em eletroporação em Portorož, Slovenia;
Em 2017: publicação do livro Handbook of Electroporation (MIKLAVCIC, 2017);
Em 2018: atualização do ESOPE (GEHL et al., 2018).
MECANISMOS DA ELETROPORAÇÃO DA PELE
A composição biológica e a estrutura do estrato córneo, a camada mais externa da pele, o tornam particularmente atraente para a eletroporação. O estrato córneo contém aproximadamente 100 membranas de bicamada em série, e a aplicação de uma corrente elétrica está associada a alterações estruturais nesta membrana. Foi observado um aumento no transporte molecular para voltagens transdérmicas de 10-500 V, o que corresponde bem à faixa de voltagens usadas para eletroporação em células, ou seja, 0,3-1,0 V por bicamada. Pulsos elétricos de curta duração, na ordem de microssegundos a segundos, provocam uma queda significativa na resistência da membrana celular. A eletroporação ocorre em função de parâmetros do campo elétrico, por exemplo, a amplitude. Desta forma, pode aumentar o transporte transdérmico de substâncias hidrofílicas e com maior peso molecular, além de uma ampla gama de aplicações na biotecnologia e na medicina, como tratamento de câncer, vacinas de DNA, ablação tecidual e desativação microbiana. Na Figura 7 pode ser observado que novas vias aquosas seriam criadas dentro do estrato córneo devido à eletroporação de suas bicamadas lipídicas. O aumento da temperatura no local da aplicação é conhecido na literatura como algo desprezível para a maioria dos casos.
ELETROPORADOR
A aplicação da eletroporação necessita de um eletroporador. Este equipamento opera com saída de pulsos de tensão na ordem de centenas de Volts e corrente na ordem de dezenas de Amperes. O eletroporador necessita de eletrodos para aplicação de campos elétricos em tecidos biológicos ou amostras biológicas.
É de conhecimento que a eletroporação tem relação com amplitude, frequência, forma, número e taxa de repetição do pulso. A combinação de diversas possibilidades paramétricas (amplitude, duração e número de pulsos), inseridas pelo operador do eletroporador, possibilita atingir de maneira reversível ou irreversível os sistemas celulares de células animais e vegetais, seja esses preparados em suspensão de células ou tecido, in vivo ou in vitro. Os parâmetros elétricos dos pulsos (forma da onda, voltagem, duração e intervalo entre pulsos), as propriedades físico-químicas das moléculas (carga, lipofilicidade e peso molecular), bem como o seu reservatório influenciam o controle da administração transdérmica dos fármacos por eletroporação. O equipamento eletroporador corresponde a um gerador tanto de pulsos de decaimento exponencial (ED) quanto de pulsos de onda quadrada (SW).
Atualmente não existe, no mercado brasileiro, um aparelho eletroporador para uso estético que siga o protocolo estabelecido pela técnica. No artigo The Effect of Electroporation of a Lyotropic Liquid Crystal Genistein-Based Formulation in the Recovery of Murine Melanoma Lesions, o aparelho Mezoforte Duo Mez 120905-D foi usado na pele de camundongos para observar a redução de tumores através do uso da genisteína e eletroporação. Este equipamento foi o mais próximo encontrado nesta revisão de literatura para uso estético. Porém, foi encontrado nesta revisão um aparelho desenvolvido pelo Engenheiro Eletricista Guilherme Brasil Pintarelli em sua dissertação de mestrado em 2018 na UFSC (Universidade Federal de Santa Catarina). Este equipamento eletroporador foi desenvolvido para aplicação de pulsos de tensão elétrica de amplitude, período e forma de onda variáveis e análise técnicas de eletroporação na transfecção genética e tratamento de neoplasias (Figura 8).

Abaixo encontram-se alguns modelos de eletroporador usados principalmente em pesquisas celulares.
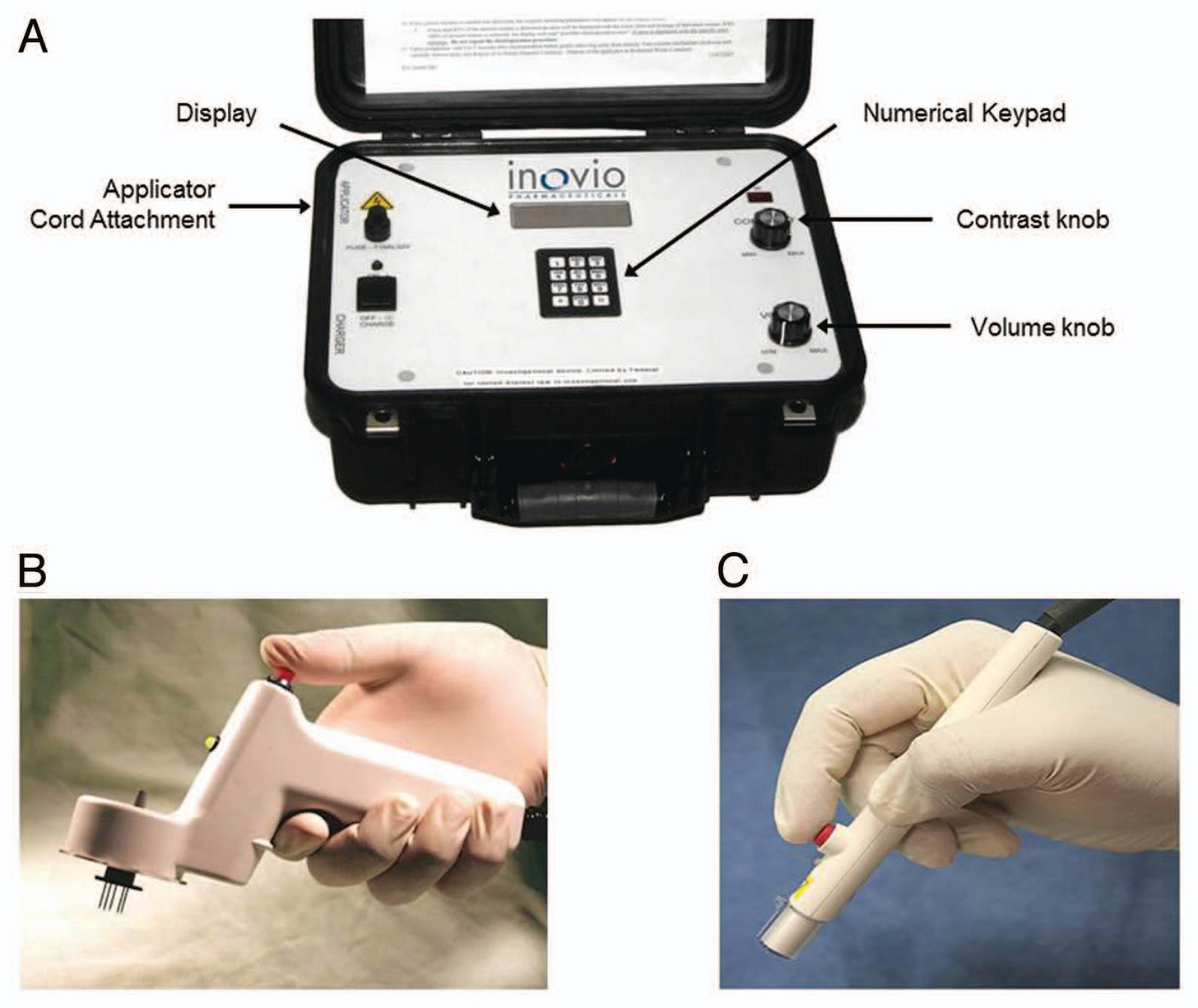
O dispositivo de eletroporação CELLECTRA®, desenvolvido pela Inovio Pharmaceuticals, Inc., está atualmente sendo avaliado em estudos clínicos para fins de investigação, tanto para indicações profiláticas quanto terapêuticas. Este dispositivo fornece pulsos elétricos de onda quadrada aplicando um campo elétrico adaptativo baseado em corrente constante, em vez de voltagem constante.
FENÔMENO DE FORMAÇÃO DO PORO
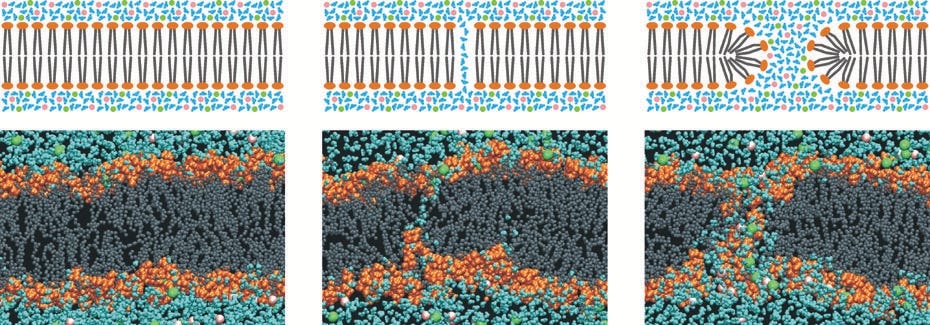
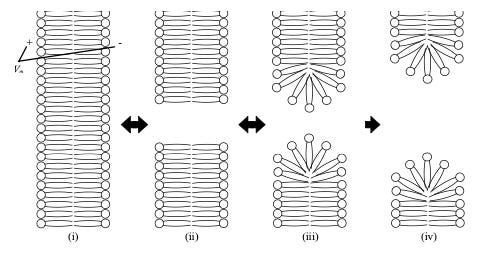
As quatro principais etapas envolvidas na reorganização transiente da membrana são:
Etapa i: Membrana íntegra e indução do potencial transmembrana: Não há detecção de eletroporação. A aplicação de campo elétrico externo (1ns a 1s) induz aumento do potencial transmembrana. O carregamento da membrana deve-se ao fluxo de íons, conforme representado na figura 11. Quando o potencial transmembrana (V) atinge um valor crítico (superior a 200 mV, e na maioria dos casos pode atingir 1 a 1,5 V em células eucariontes), inicia-se a reorganização molecular da membrana (Etapa ii). Observa-se que o potencial transmembrana é equivalente a um campo elétrico sobre a membrana da ordem de 10⁸ V/m (em porção típica de membrana de 5 nm).
Etapa ii: Formação de poros hidrofóbicos (ou pré-poros): Aqui caminhos temporários e limitados para o transporte molecular são formados. Mas depois de cessar o pulso elétrico, o transporte cessa e a célula se mantém viva. O potencial transmembrana crítico desencadeia uma “explosão” de reorganizações na estrutura molecular da membrana. Nessa situação, o campo elétrico entre a membrana dielétrica é superior ao que essa estrutura pode suportar. Esse tipo de poro é instável e desaparece por flutuações naturais da membrana caso seu raio seja menor que o raio crítico (retorna à Etapa i). Caso ele apresente um raio superior ao raio crítico, ele torna-se um poro hidrofílico (Etapa iii).
Etapa iii: Formação de poros hidrofílicos (reversíveis): As cabeças das moléculas lipídicas “giram” para o interior da parede dos poros (forma toroidal), isso minimiza o contato das caudas de lipídeos, que são hidrofóbicas, com as moléculas de água presentes nos meios extra e intracelular. O interior do poro é preenchido com água, e esse acontecimento permite o transporte de íons e outras moléculas através da membrana.
O raio crítico é o raio limiar para o poro hidrofóbico tornar-se poro hidrofílico. O sistema se reorganiza na configuração que necessita a menor quantidade de energia para existir. O raio crítico é teórico e observado com auxílio de modelos matemáticos de reorganização da membrana em nível molecular. acontecimento permite o transporte de íons e outras moléculas através da membrana.
Etapa iv: Formação de poros irreversíveis (destruição da membrana): Caso a amplitude do campo elétrico aplicado seja muito elevada, são criados poros irreversíveis. Nesse estado, a membrana não é capaz de retornar ao estado inicial. A recuperação (resealing) ou não da membrana dependerá da operação reversível ou irreversível da eletroporação, que depende dos parâmetros do campo e condições do sistema biológico. A densidade e raio dos poros podem depender de condições do sistema biológico (tamanho, formato, tipo e concentração celulares e tipos de tecidos) e parâmetros de eletroporação (amplitude, duração e forma de onda de campo elétrico aplicado).
Eletroporação Reversível
Quando uma célula eucariótica tem a integridade de sua membrana plasmática rompida, esta tem a incrível capacidade de reparar o dano — um processo chamado resselagem de membrana, que é fundamental para manter a homeostase celular e prevenir a morte celular. No entanto, a pesquisa sobre esse fenômeno intrigante é bastante limitada. Como mencionado acima, os poros da membrana podem ser criados por um campo elétrico aplicado à célula. Normalmente, após a remoção de uma carga elétrica de curta duração, os orifícios na membrana podem ser auto-selados, o que é conhecido como eletroporação reversível. A eletroporação reversível é usada normalmente para a entrega de macromoléculas na pele.
Eletroporação Irreversível
Por outro lado, também foi descoberto que uma vez que a magnitude ou duração do campo elétrico aplicado está além de um nível limiar, o dano na membrana celular pode ser permanente (ou seja, os poros da membrana neste caso não podem mais ser fechados, o que eventualmente resulta em morte celular). Este fenômeno é conhecido como eletroporação irreversível. A EP irreversível é utilizada para ablação de tecidos, diminuindo ou eliminando tumores.
CONSIDERAÇÕES DA OBSERVAÇÃO DA ELETROPORAÇÃO
Para voltagens transmembranares de centenas de milivolts, o número de poros se torna grande o suficiente, e seus tempos de vida médios são longos o suficiente (de milissegundos a minutos), para um aumento detectável da permeabilidade da membrana a moléculas que de outra forma seriam incapazes de atravessar a membrana.
Semelhante à formação de poros, a resselagem de poros é um processo estocástico, mas ocorre em uma escala de tempo muito mais longa. Especificamente, a formação de eletroporos leva de nano a microssegundos, enquanto sua vedação – revelada pelo retorno da condutividade elétrica da membrana ao seu valor de pré-poração e pelo término do transporte transmembranar detectável – geralmente é completada apenas em segundos, ou mesmo minutos, após o fim da exposição.
O princípio molecular da formação de poros (e transporte molecular através da membrana) ainda não é completamente entendido. Chang, em 1990, desenvolveu uma técnica de “congelamento rápido após eletroporação” seguida de técnica de microscopia e obteve imagens de estruturas semelhantes aos poros, porém a experimentação não foi reproduzida novamente. Os poros aquosos na bicamada têm raios de no máximo vários nanômetros, o que é muito pequeno para ser observável por microscopia óptica, e a preparação da amostra necessária para microscopia eletrônica de matéria mole (vacuumização, fixação e/ou revestimento metálico) é muito dura para preservação confiável de estruturas semiestáveis na bicamada, de modo que os poros não possam ser claramente distinguidos dos artefatos. As técnicas de microscopia são agressivas e afetam a estrutura de poros. Atualmente, não há técnica experimental definitiva para observação direta da eletroporação (abertura de poros) e há esforços para descoberta de novas metodologias. A eletroporação geralmente é estudada com base em medições indiretas. No entanto, há evidências bastante convincentes em favor da teoria da formação de poros aquosos na forma de simulações de dinâmica molecular. Essas simulações confirmam amplamente a visão hipotética da sequência de eventos em escala molecular e também mostram um claro aumento na taxa de formação de poros com o aumento do campo elétrico ao qual a membrana é exposta - primeiro através da ação direta do campo externo, e então aumentada pela indução da voltagem transmembrana resultante da polarização.
No entanto, a duração desses microporos aquosos pode ser aumentada quando a eletroporação é acoplada com intensificadores químicos, iontoforese ou sonoforese.
DISCUSSÃO
A primeira questão chave abordada neste estudo através da literatura foi avaliar a viabilidade da entrega transdérmica de macromoléculas por eletroporação da pele. Segundo o trabalho de Prausnitz em 1997, devido às grandes propriedades de barreira da pele, a entrega de compostos de alto peso molecular não era uma opção realista. No entanto, os dados mostram que a eletroporação da pele pode ser um método muito promissor.
A eletroporação é um método eficiente para melhorar a entrega transdérmica de drogas in vitro e in vivo, e expande a gama de compostos entregues transdermicamente. Pode ser uma alternativa promissora como entrega não invasiva de macromoléculas pelo menos de 40 kDa e entrega transdérmica rápida e/ou pulsátil. Combinada com outros métodos de intensificação, a eletroporação pode proporcionar entrega modulada e adequada de acordo com o tratamento. O protocolo de pulso e o desenho do eletrodo precisam ser otimizados para reduzir o principal efeito adverso, ou seja, a contração muscular.
Segundo o artigo de Yarmush et al., a eletroporação demonstrou criar vias aquosas através do estrato córneo e, assim, aumentar a distribuição transdérmica de drogas. Ao referir-se às suas propriedades elétricas, a pele é um tecido muito intrincado devido à sua estrutura altamente heterogênea. É composto por três camadas principais: epiderme (importante na resposta imune), derme (dá firmeza e elasticidade) e tecido subcutâneo (absorvedor de tensão mecânica, função termo-isolante). Mas a parte que mais define suas propriedades elétricas é a camada mais externa, o estrato córneo. Apesar de muito fino (normalmente em torno de 20 µm), contribui muito para as propriedades elétricas da pele. É de baixa condutividade (três a quatro ordens de magnitude menor do que as condutividades das camadas mais profundas da pele) tornando a pele um dos tecidos menos condutores do ser humano. A resistência elétrica do estrato córneo é de ordem de magnitude maior do que a dos tecidos mais profundos, e o alto campo elétrico resultante da aplicação de pulsos elétricos permanece principalmente no estrato córneo. Com o resultado da eletroporação, a resistência do estrato córneo diminui rapidamente e o campo elétrico se distribui nas camadas mais profundas do tecido (Figura 12).
PAV j ELJ et al. observaram, a partir de experimentos in vivo atuais e anteriores, a dependência não linear de corrente/tensão medida durante a entrega de pulso, sugerindo mudanças na condutividade do tecido durante a eletropermeabilização do tecido. As camadas de pele podem ser vistas como resistores conectados em série. A aplicação de tensão em tal circuito (conhecido como divisor de tensão) faz com que a tensão seja distribuída entre os resistores proporcionalmente às suas resistividades. Ao aplicar pulsos elétricos na dobra da pele através de eletrodos de placa externa, quase toda a tensão aplicada repousa sobre o estrato córneo altamente resistivo (pouco condutor), o que causa um campo elétrico muito alto nessa camada. Ao mesmo tempo, o campo elétrico nas camadas mais profundas da pele – as camadas direcionadas para a transfecção de genes – permanece muito baixo para uma eletropermeabilização bem-sucedida. Este fato levanta a questão de como uma entrega bem-sucedida de DNA mediada por eletroporação para a derme e a epiderme viável ainda é possível quando eletrodos de placa externa são usados. A hipótese descrita pelos autores está no aumento da condutividade das camadas da pele durante a eletroporação, fenômeno que também foi observado in vivo para outros tecidos. Camadas da pele abaixo do estrato córneo a um campo elétrico alto o suficiente para uma permeabilização bem-sucedida. Para apoiar esta ideia foi descrito o processo de eletropermeabilização da pele através de um modelo numérico, levando em consideração a estrutura em camadas da pele e as mudanças de suas propriedades elétricas durante a eletropermeabilização. Tal modelo fornece uma compreensão mais profunda do processo de eletropermeabilização da pele e, ainda mais aprimorado, permitirá prever o resultado da entrega do pulso antes do tratamento, ajudando assim na otimização/escolha dos parâmetros de pulso corretos e no desenvolvimento de geometrias de eletrodos.
CONCLUSÃO
A administração de fármacos pela via transdérmica constitui uma alternativa viável para ultrapassar as limitações das vias mais comuns, tendo-se revelado uma área de investigação atrativa e desafiante. No sentido de diminuir a função barreira da camada córnea da pele e aumentar a permeação dos fármacos, várias estratégias têm sido desenvolvidas nas últimas décadas. A eletroporação é uma técnica muito promissora para liberação de macromoléculas e drogas hidrofílicas por via transdérmica.
A eletroporação é uma tecnologia de plataforma multidisciplinar com múltiplas aplicações médicas. O sinergismo entre eletroporação, iontoforese, bem como os métodos químicos podem fornecer a força motriz necessária para a distribuição transdérmica. Embora uma compreensão completa dos mecanismos fundamentais nos níveis celular e tecidual ainda não tenha sido desenvolvida, sem dúvida veremos um aumento nas aplicações médicas da eletroporação nos próximos anos.
REFERÊNCIAS BIBLIOGRÁFICAS
Soares M, Vitorino C, Sousa J, Pais A. Permeação cutânea: desafios e oportunidades. Rev Ciênc Farm Básica Apl. 2015;36(3):337-48.
Charoo NA, Rahman Z, Repka MA, Murthy SN. Electroporation: An Avenue for Transdermal Drug Delivery. Curr Drug Deliv. 2010;7(2):125-36.
Hadgraft J, Guy HR. Transdermal drug delivery. New York: Marcel Dekker; 1989.
Naik A, Kalia YN, Guy RH. Transdermal drug delivery: overcoming the skin’s barrier function. Pharm Sci Technolo Today. 2000;3(9):318-26.
Menon GK, Cleary GW, Lane ME. The structure and function of the stratum corneum. Int J Pharm. 2012;435(1):3-9.
Michaels AS, Chandrasekaran SK, Shaw JE. Drug permeation through human skin: theory and in vitro experimental measurement. AIChE J. 1975;21(5):985-96.
Shi J, Ma Y, Zhu J, Chen Y, Sun Y, Yao Y, et al. A Review on Electroporation-Based Intracellular Delivery. Molecules. 2018;23(11):3044.
Pintarelli BG. Técnicas de Eletroporação: Dispositivo Eletrônico e Ensaios em Leveduras [Dissertação]. Florianópolis: Universidade Federal de Santa Catarina; 2018. 167 p.
Kotnik T, Rems L, Tarek M, Miklavčič D. Membrane Electroporation and Electropermeabilization: Mechanisms and Models. Annu Rev Biophys. 2019;48:63-91.
Weaver JC. Electroporation Theory Concepts and Mechanisms. In: Nickoloff JA, editor. Electroporation Protocols for Microorganisms. Totowa, NJ: Humana Press; 1995. p. 1-26.
Dhote V, Bhatnagar P, Mishra PK, Mahajan SC, Dinesh K, Mishra DK. Iontophoresis: A Potential Emergence of a Transdermal Drug Delivery System. Sci Pharm. 2012;80(1):1-28.
Tokumoto S, Higo N, Sugibayashi K. Effect of electroporation and pH on the iontophoretic transdermal delivery of human insulin. Int J Pharm. 2006;326(1-2):13-9.
Rubinsky B. Irreversible Electroporation. Berlin, Heidelberg: Springer; 2010.
Neumann E, Schaefer-Ridder M, Wang Y, Hofschneider PH. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1982;1(7):841-5.
Blazek AD, Paleo BJ, Weisleder N. Plasma Membrane Repair: A Central Process for Maintaining Cellular Homeostasis. Physiology (Bethesda). 2015;30(6):438-48.
Pliquett U, Langer R, Weaver JC. Changes in the passive electrical properties of human stratum corneum due to electroporation. Biochim Biophys Acta. 1995;1239(1):111-21.
Pliquett U. Mechanistic studies of molecular transport due to skin electroporation. Adv Drug Deliv Rev. 1999;35(1):41-60.
Davalos RV, Rubinsky B. Temperature considerations during irreversible electroporation. Int J Heat Mass Transf. 2008;51(23-24):5617-22.
Yarmush ML, Golberg A, Sersa G, Kotnik T, Miklavcic D. Electroporation-based Technologies for Medicine: Principles, applications, and Challenges. Annu Rev Biomed Eng. 2014;16:295-320.
Paudel KS, Milewski M, Swadley CL, Brogden NK, Stinchcomb AL. Challenges and opportunities in dermal/transdermal delivery. Ther Deliv. 2010;1(1):109-31.
Chen C, Smye SW, Robinson MP, Evans JA. Membrane electroporation theories: a review. Med Biol Eng Comput. 2006;44(1-2):5-14.
Danciu C, Berkó S, Varju G, Balázs B, Kemény L, Németh IB, et al. The Effect of Electroporation of a Lyotropic Liquid Crystal Genistein-Based Formulation in the Recovery of Murine Melanoma Lesions. Int J Mol Sci. 2015;16(7):15425-41.
Diehl MC, Lee JC, Daniels SE, Tebas P, Khan AS, Giffear M, et al. Tolerability of intramuscular and intradermal delivery by CELLECTRA® adaptive constant current electroporation device in healthy volunteers. Hum Vaccin Immunother. 2013;9(10):2246-52.
Saulis G, Venslauskas MS, Naktinis J. Kinetics of pore resealing in cell membranes after electroporation. Bioelectrochem Bioenerg. 1991;26(1):1-13.
Chang DC, Reese TS. Changes in membrane structure induced by electroporation as revealed by rapid-freezing electron microscopy. Biophys J. 1990;58(1):1-12.
Napotnik TB, Miklavčič D. In vitro electroporation detection methods - An overview. Bioelectrochemistry. 2018;120:166-82.
Delemotte L, Tarek M. Molecular dynamics simulations of lipid membrane electroporation. J Membr Biol. 2012;245(9-10):531-43.
Prausnitz MR, Edelman ER, Gimm JA, Langer R, Weaver JC. Transdermal Delivery of Heparin by skin electroporation. Biotechnology (N Y). 1995;13(11):1205-9.
Lombry C, Dujardin N, Préat V. Transdermal Delivery of Macromolecules Using Skin Electroporation. Pharm Res. 2000;17(1):32-7.
Yan K, Todo H, Sugibayashi K. Transdermal drug delivery by in-skin electroporation using a microneedle array. J Drug Deliv Sci Technol. 2017;41:212-8.
Regnier V, O’Brien-Moran E, Jadoul A, Préat V. Mechanisms of a phosphorothioate oligonucleotide delivery by skin electroporation. Int J Pharm. 1999;184(2):147-56.
Pavšelj N, Préat V, Miklavčič D. A numerical model of skin electropermeabilization based on in vivo experiments. Ann Biomed Eng. 2007;35(12):2138-44.
Riviere JE, Riviere NAM, Rogers RA, Bommannan D, Tamada JA, Potts RO. Pulsatile transdermal delivery of LHRH using electroporation: drug delivery and skin toxicology. J Control Release. 1995;36(3):229-33.
Zewert TE, Pliquett UF, Langer R, Weaver JC. Transdermal transport of DNA antisense oligonucleotides by electroporation. Biochem Biophys Res Commun. 1995;212(2):286-92.
Zhang Y, Yan Z, Xia X, Lin Y. A Novel Electroporation System for Living Cell Staining and Membrane Dynamics Interrogation. Micromachines (Basel). 2020;11(8):767.
Denet AR, Vanbever R, Préat V. Skin electroporation for transdermal and topical delivery. Adv Drug Deliv Rev. 2004;56(5):659-74.
Kotnik T, Frey W, Sack M, Meglic SH, Peterka M, Miklavcic D. Electroporation-based applications in biotechnology. Trends Biotechnol. 2015;33(8):480-8.