Benefícios do Uso da Fibrina Injetável Rica em Plaquetas (iPRF) como um Bioestimulador de Colágeno e Elastina no Rejuvenescimento Facial
Revisão De Literatura
O universo da estética está em constante evolução, e uma das tendências mais fortes é a busca por procedimentos que ofereçam resultados naturais, seguros e minimamente invasivos. Nesse cenário, a Fibrina Injetável Rica em Plaquetas, ou simplesmente i-PRF, surge como uma verdadeira revolução. Trata-se de uma técnica que utiliza o poder regenerativo do próprio sangue do paciente para estimular a produção de colágeno e elastina, combatendo os sinais do envelhecimento de dentro para fora.
Mas quais são os reais benefícios dessa técnica? Como ela funciona e o que a ciência diz sobre sua eficácia? Para desvendar todos os segredos do i-PRF, mergulhamos no trabalho de conclusão de curso de Tarcia Kambilis Garbini, apresentado para obtenção do título de especialista em Harmonização Orofacial pelo Centro Universitário Ingá (UNINGÁ).
Continue a leitura e descubra como essa abordagem inovadora está transformando a harmonização orofacial.
A redução da taxa de natalidade e o aumento da expectativa de vida estão levando o mundo contemporâneo à chamada “era do envelhecimento” (MOREIRA e NOGUEIRA, 2008; SANTOS, ZOBOLI e CORREIA, 2013).
Na última década tivemos muitos avanços tecnológicos na área da saúde contribuindo com a evolução dos tratamentos estéticos dentro da odontologia e os indivíduos passaram a entender que temos uma relação muito próxima dos tecidos faciais com todas as estruturas bucais. E quando um tratamento estético facial é bem executado vamos ter a complementação de toda a reabilitação estética funcional realizada pelo cirurgião-dentista.
O envelhecimento é um fenômeno fisiológico, dinâmico, progressivo e irreversível do organismo, caracterizado pelo declínio funcional e estrutural de todas as camadas da pele. Com o avançar da idade podemos observar ressecamento da pele, presença de rugas, perda da elasticidade (flacidez) e alteração na pigmentação (manchas). O envelhecimento ocorre tanto por fatores intrínsecos ou extrínsecos. No caso do envelhecimento intrínseco depende da genética individual de cada um, sendo inevitável e está fora do seu controle. Já os fatores extrínsecos (tabagismo, poluição, exposição solar, alimentação inadequada), podem ser controlados.
No envelhecimento ocorre a perda e degradação do colágeno proveniente do fotoenvelhecimento ou pelo próprio envelhecimento intrínseco. Com o envelhecimento, os ossos vão sofrendo reabsorção, levando à flacidez dos ligamentos que colaboram para o deslocamento de todas as gorduras e ocorre uma considerável perda na sintetização do ácido hialurônico (HA) cutâneo, colágeno, elastina levando ao aparecimento de rugas, rítides e perda do volume facial.
Tivemos um aumento na diversidade de produtos estéticos e o aparecimento dos bioestimuladores injetáveis, fibrina rica em plaquetas injetável (IPRF) que possuem uma propriedade menos invasiva, já que são autólogos e fornecidos pelo próprio paciente com uma capacidade muito eficiente no rejuvenescimento facial conferindo hidratação, bioestimulação de colágeno e elastina através da ativação do fibroblasto dando uma grande melhora na sustentação dos tecidos faciais, conferindo melhor resistência tecidual frente ao estímulo dos fatores de crescimento injetados, melhorando a microcirculação sanguínea local, bioestimulando a neocolagenase, produção de elastina, angiogênese, revertendo dessa maneira, os efeitos de envelhecimento da derme (SCAFLANI, 2011).
Nas últimas décadas houve avanços científicos significativos em busca de aprimoramento nas técnicas e já temos estudos que apoiam a associação IPRF ao tratamento com HA, sendo muito vantajosos sem alterar as características relevantes originais de ambos os produtos (ULUSAL, 2016).
Os efeitos de ambos os produtos associados, quando injetados, podem aumentar a função anabólica dos fibroblastos dérmicos (ULUSAL, 2016).
Com essas técnicas menos invasivas, podemos prevenir ou amenizar o envelhecimento, tornando-o mais sutil, lento e uniforme.
OBJETIVO
O presente trabalho, realizado por meio de revisão de literatura, teve como objetivo verificar os benefícios do uso da fibrina injetável rica em plaquetas como um bioestimulador de colágeno no rejuvenescimento facial.
Para tanto, foi realizado um levantamento nos principais bancos de dados na internet, abrangendo o período de 2006 a 2020.
REVISÃO DA LITERATURA
Segundo Choukroun et al. (2006), a fibrina rica em plaquetas (PRF) pertence a uma nova geração de concentrados de plaquetas, com processamento simplificado e sem manuseio bioquímico do sangue. Em seu artigo, os autores investigaram a biologia da PRF avaliada anteriormente com os primeiros resultados clínicos estabelecidos, para determinar os campos potenciais de aplicação deste biomaterial. O raciocínio está estruturado em torno de quatro eventos fundamentais da cicatrização: angiogênese, controle imunológico, aprisionamento de células-tronco circulantes e epitelização de cobertura de feridas. Todas as aplicações clínicas conhecidas da PRF destacam uma cicatrização tecidual acelerada, devido ao desenvolvimento eficaz de neovascularização, fechamento acelerado de feridas com rápido remodelamento do tecido cicatricial e ausência quase total de eventos infecciosos. Portanto, esta pesquisa inicial torna possível planejar aplicações futuras da PRF, incluindo cirurgia plástica e óssea, desde que os efeitos reais sejam avaliados de modo imparcial e rigoroso.
Sclafani (2011) realizou um estudo para avaliar a segurança clínica e a eficácia do uso da matriz autóloga de fibrina rica em plaquetas (PRFM) em cirurgia plástica facial. Os prontuários dos últimos 50 pacientes com pelo menos 3 meses de seguimento tratados pelo autor com PRFM para fins estéticos foram revisados quanto à satisfação do paciente, resultados clínicos objetivos e eventos adversos. Os resultados mostraram que a maioria dos pacientes foi tratada para sulcos nasolabiais profundos, enquanto a região da face média depletada de volume, rítides superficiais e cicatrizes de acne foram outras áreas comumente tratadas. Os pacientes foram submetidos a uma média de 1,6 tratamentos (variação, 1-5 tratamentos). Nenhum paciente relatou qualquer inchaço com duração superior a 5 dias e a maioria notou apenas hematomas mínimos, que duraram de 1 a 3 dias. A maioria dos pacientes ficou satisfeita com os resultados de seus tratamentos, embora um paciente tenha sentido que houve melhora limitada ou nenhuma melhora após 2 tratamentos. O autor concluiu que o tratamento com PRFM autóloga é uma escolha excelente e bem tolerada para uso no rosto.
Em seu estudo, Sclafani e McCormick (2012) avaliaram as alterações histológicas induzidas na pele humana por injeção de matriz autóloga de fibrina rica em plaquetas (PRFM). Foram incluídos no estudo 4 voluntários adultos saudáveis. A matriz de fibrina rica em plaquetas foi preparada a partir de 9 mL de sangue autólogo, usando um sistema proprietário (Selphyl; Aesthetic Factors, Wayne, New Jersey) e injetada na derme profunda e na subderme imediata da parte superior do braço dos indivíduos. Espécimes de biópsia de pele de espessura total foram retirados das áreas tratadas ao longo de um período de 10 semanas e os espécimes foram processados para avaliação histológica. Os achados do exame histológico apoiaram a observação clínica do aumento dos tecidos moles. Já em 7 dias após o tratamento, fibroblastos ativados e nova deposição de colágeno foram observados e continuaram a ser evidentes ao longo do estudo. O desenvolvimento de novos vasos sanguíneos foi observado em 19 dias; também nesta época, foram observadas coleções intradérmicas de adipócitos e estimulação de adipócitos subdérmicos. Essas descobertas tornaram-se mais pronunciadas ao longo do estudo, embora a resposta fibroblástica tenha se tornado muito menos pronunciada. Nenhuma figura mitótica anormal foi observada em qualquer ponto e uma resposta inflamatória crônica muito leve foi observada apenas nos primeiros momentos do estudo. Os autores concluíram que a injeção de PRFM na derme profunda e subderme da pele estimula uma série de alterações celulares que podem ser aproveitadas para uso. Juntamente com estudos anteriores in vitro e in vivo, agora há uma imagem muito mais clara dos efeitos celulares do PRFM e seus usos potenciais em cirurgia plástica facial.
Segundo Keyhan et al. (2013), a lipoenxertia sempre representou um desafio na indução da neoangiogênese necessária, que resulta em reabsorção significativa. Os autores realizaram um estudo para comparar a eficiência dos plasmas ricos em plaquetas (PRPs) de primeira e segunda geração, combinados com um enxerto de gordura durante a cirurgia de lipoestrutura facial. Para tanto, os pesquisadores projetaram e implementaram um ensaio clínico prospectivo duplo-cego. Os pacientes foram submetidos à lipoestrutura facial bilateral, um método natural de longa duração de preenchimento e sustentação da face por meio de camadas intrincadas de gordura autóloga infiltrada. O método envolveu o uso de PRP em um lado e fibrina rica em plaquetas (PRF) no outro lado. A população do estudo foi composta por todos os pacientes que se apresentaram ao departamento dos autores para avaliação e tratamento do contorno facial nas áreas de bochecha e maçã do rosto de junho de 2008 a dezembro de 2010. A variável preditora primária foi o tipo de combinação (PRP/gordura ou PRF/gordura). As variáveis de resultado foram a quantidade de reabsorção, que foi estimada pela comparação das visualizações fotográficas pré e pós-cirúrgica, dor, edema e hematomas. A avaliação estatística dos achados foi realizada no software SPSS. Testes paramétricos (teste t e teste de Levene) foram usados para comparar a eficácia do tratamento e complicações entre os grupos. Os resultados mostraram que 25 pacientes (8 homens e 17 mulheres) foram submetidos à cirurgia de lipoestrutura facial bilateral nas áreas de bochecha e osso malar com PRP e PRF. Após um ano da operação, notou-se leve assimetria estética, com maior reabsorção média do lado PRP/gordura. Os autores concluíram que o estudo destaca o valor do uso de plaquetas concentradas para enxertos de adipócitos. Os resultados sugerem que a combinação de gordura e PRF é mais eficaz do que a combinação de gordura e PRP no contexto da cirurgia de lipoestrutura facial.
De acordo com Borie et al. (2015), o desenvolvimento de aditivos cirúrgicos bioativos para regular a inflamação e aumentar a velocidade do processo de cicatrização é um dos grandes desafios na pesquisa clínica. Nesse sentido, a fibrina rica em plaquetas (PRF) surge como uma alternativa natural e satisfatória, com resultados favoráveis e baixos riscos. Os autores realizaram uma revisão para tentar resumir a literatura relevante relativa à técnica de uso da PRF, com foco em sua preparação, vantagens e desvantagens de utilizá-la em aplicações clínicas. A PRF, sozinha ou em combinação com outros biomateriais, parece ter várias vantagens e indicações, tanto para a medicina como para a odontologia, visto ser uma técnica minimamente invasiva, com baixos riscos e resultados clínicos satisfatórios.
Verma et al. (2017) afirmam que a regeneração do tecido periodontal sempre foi um desafio para os periodontistas, devido à sua complexidade estrutural. Apesar de a engenharia de tecidos ser um campo multidisciplinar em crescimento, esse objetivo foi parcialmente atendido. Nos últimos anos, a fibrina rica em plaquetas (PRF) ganhou grande atenção por sua utilização como um material regenerativo biocompatível não apenas na área odontológica, mas também na área médica. Os autores realizaram uma revisão sistemática reunindo todos os estudos in vitro, em animais e clínicos atualmente disponíveis, utilizando o banco de dados eletrônico PubMed de janeiro de 2006 a agosto de 2016, destacando a PRF para regeneração de tecidos moles e duros e/ou cicatrização de feridas. Apesar dos resultados serem encorajadores, ainda necessitam validação adicional de estudos clínicos para justificar o papel potencial da PRF na regeneração periodontal, de modo que este biomaterial autólogo relativamente barato possa ser utilizado em uma escala mais ampla.
Miron et al. (2017a) dizem que, agora, a pesquisa em muitos campos da medicina aponta para as vantagens clínicas de combinar procedimentos regenerativos com fibrina rica em plaquetas (PRF). Os autores realizaram uma revisão sistemática da literatura com o objetivo de reunir os artigos publicados sobre PRF na área odontológica, para melhor compreender os procedimentos clínicos onde a PRF pode ser utilizada para melhorar a formação de tecido/osso. Foram selecionados 35 artigos. Os autores concluíram que, no geral, o uso da PRF tem sido mais investigativo na periodontologia para o tratamento de defeitos periodontais intra-ósseos e recessões de gengiva, onde a maioria dos estudos demonstraram resultados favoráveis no controle e reparo de tecido mole. Há poucos testes clínicos randomizados.
Segundo Miron et al. (2017b), o plasma rico em plaquetas (PRP) tem sido utilizado na odontologia regenerativa como um concentrado suprafisiológico de fatores de crescimento autólogos, capazes de estimular a regeneração de tecidos. Apesar disso, foram expressas preocupações em relação ao uso de anticoagulantes, agentes conhecidos por inibir a cicatrização de feridas. Neste estudo, foi investigada uma formulação líquida de fibrina rica em plaquetas (PRF) denominada PRF injetável (i-PRF) sem o uso de anticoagulantes. PRP padrão e i-PRF (centrifugados a 700 rpm (60G) por 3 min) foram comparados quanto à liberação de fator de crescimento em até 10 dias (8 amostras de doadores). Além disso, foram investigadas a biocompatibilidade de fibroblastos em 24 h (ensaio de vida/morte); a migração em 24 h; a proliferação em 1, 3 e 5 dias; e a expressão de PDGF, TGF-β e colágeno 1 em 3 e 7 dias. Os resultados mostraram que a liberação do fator de crescimento demonstrou que, em geral, o PRP apresentou maior liberação precoce de fatores de crescimento, enquanto a iPRF apresentou níveis significativamente maiores de liberação total em longo prazo de PDGF-AA, PDGF-AB, EGF e IGF-1 após 10 dias. O PRP apresentou níveis mais elevados de TGF-β1 e VEGF em 10 dias. Enquanto ambas as formulações exibiram alta biocompatibilidade e maior migração e proliferação de fibroblastos, quando comparadas ao plástico de cultura-tecido de controle, a i-PRF induziu migração significativamente mais alta, enquanto o PRP demonstrou proliferação celular significativamente mais alta. Além disso, a i-PRF mostrou níveis significativamente mais altos de mRNA de TGF-β em 7 dias, PDGF em 3 dias e expressão de colágeno 1 em 3 e 7 dias, quando comparada com o PRP. Os autores concluíram que a i-PRF demonstrou a capacidade de liberar concentrações mais elevadas de vários fatores de crescimento e induziu maior migração de fibroblastos e expressão de PDGF, TGF-β e colágeno 1. Pesquisas futuras em animais são agora necessárias para validar ainda mais o uso de i-PRF como um agente bioativo capaz de estimular a regeneração de tecidos. Os resultados do presente estudo demonstram que uma formulação potente de concentrado líquido de plaquetas pode ser obtida sem o uso de anticoagulantes.
De acordo com Shah et al. (2017), a fibrina rica em plaquetas (PRF) é um aditivo biológico cirúrgico que é preparado pela manipulação de sangue autólogo, que evoluiu para se tornar um dos concentrados de plaquetas mais amplamente usados na odontologia. Quase substituiu o plasma rico em plaquetas (PRP), devido às suas vantagens como ser 100% autógeno, técnica fácil, tempo e eficácia de custo, liberação superior e prolongada do fator de crescimento. A PRF encontra diversas aplicações em odontologia, incluindo o tratamento de recessão gengival, para regeneração óssea guiada em defeitos ósseos periodontais, peri-implantes e endodônticos. Desde a sua criação em 2001 por Choukroun e colaboradores, tem havido pesquisas aprofundadas sobre suas aplicações clínicas, ações biológicas e várias modificações e otimizações das técnicas. Há várias modificações do protocolo convencional, como PRF avançada, PRF injetável, lisado de PRF e PRF preparado com titânio. Os autores elaboraram um estudo com o objetivo de revisar as propriedades biológicas da fibrina rica em plaquetas e o avanço na tecnologia de PRF desde o seu início.
Albilia et al. (2020) realizaram um estudo com o objetivo de avaliar os benefícios clínicos da fibrina rica em plaquetas (PRF) em pacientes com dor e disfunção da articulação temporomandibular (ATM). Foram incluídos no estudo 48 ATM’s de 37 pacientes com distúrbio interno doloroso (DI) (classificação de Wilkes: I – V). Os pacientes receberam injeção com 1,5–2 cc de PRF dentro do espaço articular superior em intervalos de duas semanas (Figura 1). A dor e a disfunção subjetiva foram registradas por meio de uma escala visual analógica. As análises estatísticas foram realizadas usando o teste ANOVA. Os resultados mostraram que 33 das 48 ATM’s (69%) mostraram redução significativa da dor em 8 semanas, e em 3, 6 e 12 meses (respondentes). Quinze das 48 ATM’s (31%) não melhoraram (não respondentes). Os que tiveram melhor resposta às injeções de PRF líquidas foram DI nos estágios IV (78,5%) e V (100%) de Wilkes, em comparação com os estágios I (0%), II (47%) e III (33%) de Wilkes. Foi encontrada uma redução diminuição não significativa, porém notável, na disfunção. Os autores concluíram que os achados preliminares apoiam que a PRF líquida exibe efeitos analgésicos de longo prazo na maioria dos pacientes com DI da ATM.
Hurley et al. (2018) afirmam que estudos de ciência básica sugerem que as terapias ricas em plaquetas têm um efeito positivo sobre a reparação de tensões. Contudo, as evidências clínicas são conflitantes sobre se isso se traduz em aumento da cicatrização do tendão e melhores resultados funcionais. Os autores realizaram uma meta análise de testes controlados randomizados (RCT’s) encontrados na literatura, para verificar se o plasma rico em plaquetas (PRP) ou fibrina rica em plaquetas (PRF) melhorou os resultados dos pacientes no reparo artroscópico do manguito rotador. Dois revisores independentes realizaram a pesquisa bibliográfica, com um terceiro autor resolvendo quaisquer discrepâncias. Foram incluídos RCT’s comparando PRP ou PRF a um controle no reparo do manguito rotador. A qualidade da evidência foi avaliada usando a pontuação de Jadad. Os resultados clínicos foram comparados usando a razão de risco para variáveis dicotômicas e a diferença média para variáveis contínuas. Um valor de p < 0,05 foi considerado estatisticamente significativo. Foram incluídos 18 RCT’s com 1.147 pacientes. Após análise dos RCT’s, os autores concluíram que há evidência indicando que o uso de PRP no reparo do manguito rotador resulta em melhora das taxas de cicatrização, níveis de dor e resultados funcionais. Em contraste, a PRF não mostrou ter benefícios na melhora das taxas de cicatrização ou resultados funcionais do tendão.
Strauss, Stähli e Gruber (2018) realizaram um estudo com o objetivo de avaliar o impacto da fibrina rica em plaquetas (PRF) na implantodontia. A questão principal focada foi a seguinte: quais são os resultados clínicos, histológicos e radiográficos da administração de PRF para regeneração óssea e terapia de implante? Para tanto, os autores realizaram uma busca sistemática da literatura. Um total de 12 ensaios clínicos randomizados (RCT) preencheram os critérios de inclusão e foram escolhidos para extração de dados. Os estudos incluídos se concentraram na preservação do rebordo alveolar após a extração do dente, processo de osseointegração, tratamento de tecidos moles, aumento ósseo, regeneração óssea após elevação do assoalho do seio nasal e tratamento cirúrgico de peri-implantite. Nove estudos mostraram resultados superiores para PRF para qualquer uma das variáveis avaliadas, como dimensão do rebordo, regeneração óssea, processo de osseointegração, cicatrização de tecidos moles. Três estudos não conseguiram mostrar quaisquer efeitos benéficos da PRF. Nenhuma meta-análise pôde ser realizada devido à heterogeneidade dos desenhos de estudo. Os autores concluíram que há evidências moderadas que apoiam o benefício clínico da PRF na preservação do rebordo e na fase inicial da osseointegração. Ainda não está claro se a PRF pode reduzir a dor e melhorar a cicatrização dos tecidos moles. Mais pesquisas são necessárias para comentar o papel da PRF para melhorar outros resultados da terapia com implantes.
Segundo Liang et al. (2018), as propriedades de rejuvenescimento do enxerto de nanogorduras foram descritas nos últimos anos. No entanto, não está claro se a eficácia clínica do procedimento pode ser atribuída às células-tronco ou ligada a outros componentes do tecido adiposo. Neste estudo, os autores isolaram células-tronco derivadas de nanogorduras (NFSC’s) para observar suas características biológicas e avaliar a eficácia da injeção intradérmica precisa de nanogorduras combinadas com fibrina rica em plaquetas (PRF) em pacientes submetidos a tratamento de rejuvenescimento facial. NFSC’s de terceira passagem foram isoladas e cultivadas usando um método de emulsificação mecânica e seus marcadores de superfície CD foram analisados por citometria de fluxo. A natureza adipogênica e osteogênica e a capacidade de diferenciação condrogênica de NFSCs foram determinadas usando coloração com Oil Red O, coloração com vermelho de alizarina e coloração com azul Alcian, respectivamente. A função parácrina de NFSC’s foi avaliada por ensaio imunoenzimático (ELISA) em 1, 3, 7, 14 e 28 dias após o estabelecimento da cultura. Em seguida, os efeitos do PRF na proliferação de NFSC foram avaliados in vitro. Finalmente, os autores compararam o resultado em 103 pacientes com envelhecimento da pele facial que foram submetidos à injeção de PRF com nanogorduras e intradérmica (grupo de tratamento) e 128 pacientes que foram submetidos a tratamento com injeção de ácido hialurônico (AH) (grupo de controle). Os resultados nos dois grupos foram comparados avaliando as fotos tiradas no mesmo ângulo antes e após o tratamento, recuperação pós-operatória, incidência de absorção local e cistos e qualidade da pele antes do tratamento e 1, 12, 24 meses após o tratamento usando um software analisador de imagens e um instrumento de teste cutâneo SOFT5.5. Os resultados mostraram que as NFSC’s expressaram CD29, CD44, CD49d, CD73, CD90 e CD105, mas não expressaram CD34, CD45 e CD106. As NFSC’s também se diferenciaram em adipócitos, osteoblastos e condrócitos sob condições de indução apropriadas. As NFSC’s liberaram grandes quantidades de fatores de crescimento, como VEGF, bFGF, EGF e outros, e os níveis de fator de crescimento aumentaram de maneira dependente do tempo. Ao mesmo tempo, a PRF aumentou a proliferação de NFSC’s in vitro de uma maneira dependente da dose e as curvas de crescimento sob diferentes concentrações de PRF mostraram patamares 6 dias após a semeadura. A textura da pele facial foi melhorada em maior medida após a injeção combinada de nanogordura e PRF do que após a injeção de controle de HA. O grupo nanofat-PRF teve uma taxa de satisfação maior. Nenhum dos tratamentos causou complicações como infecção, anafilaxia ou parestesia durante o acompanhamento de longo prazo. Os autores concluíram que as NFSC’s demonstram excelente diferenciação multipotencial e função parácrina, e a PRF promoveu a proliferação de NFSC’s durante o estágio inicial após a semeadura. A injeção de nanogordura-PRF e HA melhora o estado da pele facial sem complicações graves, mas a primeira foi associada à maior satisfação do paciente, implicando que a injeção de nanogordura-PRF é um método seguro, altamente eficaz e duradouro para o rejuvenescimento da pele.

Conforme Ghanaati et al. (2018), a fibrina rica em plaquetas é um sistema concentrado de sangue usado para regeneração de tecido mole e tecido ósseo. Na última década, a fibrina rica em plaquetas (PRF) tem sido amplamente utilizada em vários campos de indicação, principalmente em cirurgia oral e maxilofacial. Em sua revisão, os autores investigam o nível de evidência científica de artigos publicados relacionados ao uso de PRF para regeneração óssea e de tecidos moles em odontologia e cirurgia maxilofacial. Foram encontrados 392 artigos, 72 dos quais foram classificados para cada campo de indicação. Ao comparar PRF com biomateriais versus biomaterial sozinho na elevação do seio (5 estudos; IIa), não foi encontrada diferença estatisticamente significativa. A preservação da cavidade e o aumento da crista usando PRF aumentaram significativamente a formação de osso novo em comparação com a cura sem PRF (7 estudos Ib, IIa, IIb). A reepitelização e regeneração óssea foram alcançadas em 96 de 101 pacientes com diagnóstico de osteonecrose da mandíbula relacionada à medicação (5 estudos, III). Na periodontologia, a PRF sozinha (6 estudos; Ib, IIa, IIb) ou sua combinação com biomateriais (6 estudos; Ib, IIa, IIb) melhorou significativamente a profundidade da bolsa e a perda de inserção, em comparação com um tratamento sem PRF. Mais de 70% dos pacientes fizeram parte de estudos com alto nível de evidência científica (estudos prospectivos randomizados e controlados). Essa evidência publicada (38 artigos), com alto nível científico, mostrou que a PRF é uma ferramenta benéfica que melhora significativamente a regeneração óssea e de tecidos moles. No entanto, a comunidade clínica requer uma padronização dos protocolos de PRF para examinar mais profundamente o benefício da PRF na regeneração de ossos e tecidos moles em estudos reproduzíveis, com um nível de evidência científica mais alto.
Segundo Lin e Sclafani (2018), as preparações de plaquetas, incluindo plasma rico em plaquetas (PRP) e matriz de fibrina rica em plaquetas (PRFM), contêm altas concentrações de fatores de crescimento que facilitam a cicatrização de feridas. As preparações de plaquetas são geralmente seguras de usar, pois são derivadas do próprio sangue do paciente e, portanto, normalmente possuem preço acessível. As preparações de plaquetas têm sido usadas sozinhas para preenchimento de tecido de pequeno volume, para tratamento de rugas faciais, para ajudar a manter o contorno ao realizar enxertos de gordura autóloga e para melhorar os resultados cosméticos e diminuir o tempo de recuperação após o resurfacing a laser. A PRFM pode ser uma opção melhor em comparação com a PRP, por causa de sua liberação mais lenta de fatores de crescimento e sua maior semelhança com o processo natural de coagulação e cicatrização de feridas.
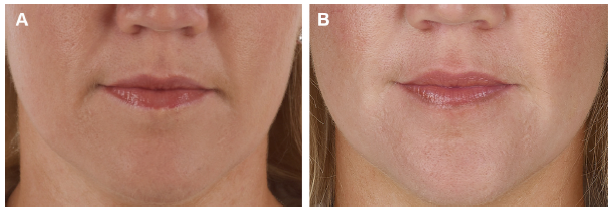
Nacopoulos e Vesala (2019) dizem que os concentrados de sangue autólogo estão cada vez mais sendo aplicados na medicina estética e odontologia, devido à sua segurança e às suas propriedades benéficas potenciais. A fibrina rica em plaquetas (PRF) com base na centrifugação de baixa velocidade, um produto sanguíneo recém-descrito, parece transmitir propriedades adicionais em vários estudos in vitro e ex vivo. Contudo, seu significado clínico em relação à regeneração facial permanece pouco fundamentado. Os autores realizaram um estudo com o objetivo de avaliar uma combinação específica de matrizes líquidas de PRF utilizadas para regeneração da face inferior (técnica de Cleopatra). A mencionada técnica foi aplicada em 32 pacientes. Além disso, para registrar as queixas e eventos adversos de todos os pacientes, foi realizado um estudo fotográfico. Os possíveis efeitos positivos foram avaliados solicitando-se a vinte e três revisores para distinguir as fotografias iniciais e posteriores de cada paciente. Os resultados mostraram que foi observada uma porcentagem estatisticamente significativa de respostas verdadeiras pelos revisores após a conclusão do tratamento (U = 110,5, P < 0,001), o que indica um efeito clinicamente significativo da técnica de Cleópatra. Além disso, foram registrados apenas alguns pequenos eventos adversos auto-limitados. Os autores concluíram que a técnica de Cleópatra é um método bem tolerado e eficaz de rejuvenescimento da face inferior, que merece mais atenção dos dentistas e outros profissionais de saúde que utilizam métodos conservadores na estética facial.
Segundo Caruana et al. (2019), nos últimos 20 anos, os concentrados de plaquetas evoluíram de produtos de primeira geração, ou seja, plasma rico em plaquetas (PRP) e plasma rico em fatores de crescimento, até produtos de segunda geração, tais como fibrina rica em plaquetas e leucócitos (L-PRF) e fibrina rica em plaquetas avançada (A-PRF). Estes produtos autólogos com maior inclusão de leucócitos e malha de fibrina flexível agem como uma armação para aumentar a migração celular no potencial antimicrobiano, angiogênico e osteogênico destes biomateriais na regeneração do tecido. Nos concentrados de plaquetas de segunda geração, os protocolos são mais fáceis, mais baratos e mais rápidos, com uma matriz de fibrina fisiológica inteira, resultando em uma malha tridimensional, não tão rígida quanto aquela das primeiras gerações. Isto permite desacelerar a liberação de moléculas por um período mais longo e desencadeia o processo de cicatrização e regeneração no local da lesão. O potencial da A-PRF de imitar a fisiologia e a imunologia da cicatrização de feridas também é devido à alta concentração de fatores de crescimento liberados, como segue: fator de crescimento endotelial vascular, fator de crescimento derivado de plaqueta, fator de crescimento transformador β e citocinas anti-inflamatórias, que estimulam a cicatrização de tecidos, formação de vasos e proliferação e diferenciação de célula óssea. Além disso, o número de neutrófilos e monócitos/macrófagos é maior, liberando importantes moléculas quimiotáticas, tais como receptor de quimiocina 5 e eotaxina. Assim, a L-PRF e A-PRF têm sido utilizadas, especialmente em implantologia, periodontologia e cirurgia maxilofacial. Aplicações clínicas futuras incluem regeneração/enxertos de tecido, necrose de úlceras/pele em pacientes diabéticos e outros, cirurgia plástica e mesmo lesões musculoesqueléticas.
Mohan et al. (2019) dizem que os concentrados de plaqueta (PC’s; plasma rico em plaquetas e fibrina rica em plaquetas) são substâncias autólogas bioativas, que têm encontrado aplicação variada nos campos médico e odontológico, particularmente em cirurgia oral e maxilofacial, cirurgia plástica e medicina esportiva. O fundamento destas tecnologias é extrair todos os elementos de amostra de sangue do próprio paciente, que pode ser usada para melhorar a cicatrização, pois promove a regeneração do tecido. Os PC’s evoluíram muito desde sua introdução em 1954. Os PC’s têm sido utilizados com sucesso em periodontia e implantodontia. Porém, a falta de padronização do protocolo de preparação, tempo de processamento, transferência de concentrados, temperatura de centrifugação, vibração, etc., contribui para os resultados mistos relatados na literatura. Em sua revisão, os autores discutem a evolução dos PC’s, suas técnicas de preparação, bem como seus aspectos clínicos e técnicos e aplicações.
Segundo Hofny et al. (2019), melasma é uma desordem cutânea hiperpigmentada facial adquirida comum. O plasma rico em plaquetas (PRP) é o plasma autólogo contendo concentrações de plaquetas superiores ao normal. Recentemente, o PRP tem sido utilizado como modalidade terapêutica no melasma com significativa melhora clínica, possivelmente devido ao seu abundante conteúdo de fatores de crescimento como o TGF-β. Este último representa um polipeptídeo multifuncional natural, que regula negativamente a diferenciação dos melanócitos e, portanto, reduz a hiperpigmentação da pele. Até o momento, não se conhece o padrão de expressão da proteína TGF-β na pele de pacientes com melasma após injeção de PRP. Os autores levantaram a hipótese de que a injeção de PRP na pele lesional de pacientes com melasma está associada a alterações na expressão da proteína TGF-β. O estudo incluiu 20 pacientes adultos com melasma. PRP autólogo foi administrado na pele da lesão por microagulhamento ou como microinjeções intradérmicas. A expressão da proteína TGF-β foi examinada imunohistoquimicamente nas peles perilesionais e lesionais antes e após o tratamento com PRP e nas peles saudáveis de 9 voluntários (grupo de controle). Os resultados mostraram que a proteína TGF-β foi expressa na epiderme, estruturas anexiais dérmicas, endotélio vascular, nervos e fibras arretoras do pilimúsculo de peles saudáveis (grupo de controle), peles perilesional e lesional de pacientes com melasma antes e após o tratamento com PRP. Antes do tratamento com PRP, a expressão da proteína TGF-β nas peles lesional (1,26 ± 0,41) e perilesional (1,68 ± 0,51) de pacientes com melasma foi significativamente menor do que nas peles saudáveis (2,26 ± 0,37, valor de p < 0,05). Após o tratamento com PRP, a expressão da proteína TGF-β aumentou significativamente na pele lesional (2,15 ± 0,44) de pacientes com melasma. Os autores concluíram que o estudo fornece a primeira indicação sobre o aumento da expressão da proteína TGF-β na pele de pacientes com melasma após o tratamento com PRP. As alterações da proteína TGF-β na pele de pacientes com melasma não apenas apoiam seus papéis no desenvolvimento dessa condição, mas também têm algumas ramificações terapêuticas.
Wang et al. (2019) dizem que as terapias regenerativas no campo da estética facial tornaram-se um campo de interesse crescente, com muitos avanços recentes feitos na última década para atender à crescente demanda mundial. Enquanto as primeiras versões de concentrados derivados de plaquetas foram formuladas com anticoagulantes (PRP), modificações recentes nas velocidades e tempos de centrifugação permitiram o desenvolvimento de uma fibrina rica em plaquetas líquida (PRF fluida) sem o uso de anticoagulantes. O estudo dos autores teve como objetivo comparar este concentrado de plaquetas totalmente natural (PRF fluida) com o PRP utilizado formalmente no comportamento e regeneração das células da pele. Foram cultivados fibroblastos de pele dérmica com PRF fluida ou PRP e investigados quanto a sua capacidade de promover/influenciar a viabilidade celular, migração, disseminação, proliferação e níveis de mRNA de mediadores conhecidos da biologia dérmica, incluindo PDGF, TGF-beta e fibronectina. Os resultados constataram que todos os concentrados de plaquetas se mostraram atóxicos para as células, demonstrando alta sobrevivência celular. Os fibroblastos da pele migraram mais de 350% a mais na PRF fluida, quando comparados ao controle e PRP (aumento de 200%). A PRF fluida também induziu significativamente uma maior proliferação celular em 5 dias. Enquanto o PRP e a PRF fluida induziram níveis significativamente elevados de mRNA celular de PDGF, foi observado que os níveis de TGF-beta, colágeno 1 e mRNA de fibronectina foram todos significativamente mais elevados no grupo de PRF fluida. Por fim, a PRF fluida demonstrou uma capacidade significativamente maior de induzir a síntese da matriz de colágeno, quando comparada com o PRP. Os autores concluíram que os achados do estudo demonstram um maior potencial regenerativo PRF fluida em fibroblastos de pele humana. É necessário o uso clínico futuro de PRF fluida no campo da estética facial, para avaliar melhor as vantagens potenciais da remoção de anticoagulante de concentrados de plaquetas.
Gentile (2020) afirmam que o processo de obtenção de produtos biológicos do sangue, incluindo PRP e PRF, pode ser complicado e caro e é influenciado por muitos fornecedores e técnicas proprietárias. Ainda há controvérsias quanto ao uso de PRP/PRF e os modos complicados ou caros de gerar estes produtos biológicos podem fazer com que muitos cirurgiões plásticos faciais abram mão de utilizar estes agentes potencialmente úteis. A falta de padronização na aquisição de PRP também tem levado a dificuldades na avaliação da eficácia clínica e comparação de protocolos de estudos. Em seu artigo os autores apresentam um protocolo fácil, simples e barato para produção de PRF injetável e tópico, que não requer protocolos de proprietário ou kits. O uso de um método de preparação de baixo custo padrão, simples, pode ajudar a padronizar os protocolos de pesquisa e permitir a comparação dos resultados de produtos biológicos de tratamento similar. A preparação fácil pode levar a um uso mais generalizado e à capacidade de estabelecer a eficácia clínica em vários procedimentos cosméticos realizados por especialistas. A formulação injetável e tópica de PRF também pode ser utilizada em cirurgia de rinoplastia, para ajudar a formar enxertos porosos para rinoplastia ou rinoplastia de revisão.
De acordo com Shashank e Bhushan (2020), a fibrina rica em plaquetas injetável (I-PRF) é um biomaterial derivado do sangue, totalmente autólogo, de segunda geração, tendo uma malha de fibrina tridimensional, como um coágulo de PRF, ao mesmo tempo que retém a natureza do fluido, do mesmo modo que o plasma rico em plaquetas (PRP). Junto com as plaquetas e seus fatores de crescimento, a PRF injetável predominantemente possui colágeno tipo 1, linfócitos, junto com seus fatores de crescimento. A preparação de PRP injetável é simples e requer instrumentação e materiais mínimos, o que o torna um produto de baixo custo. Os autores têm este biomaterial com resultados favoráveis nas condições em que o coágulo de PRP e PRF estão sendo usados atualmente, como alopecia androgenética, rejuvenescimento periorbital, preenchimento temporário e como agente promotor da cicatrização de feridas.
Gheno et al. (2020) afirmam que a regeneração óssea guiada (GBR) é um processo que envolve a regeneração de defeitos ósseos através da aplicação de membranas oclusivas, que excluem mecanicamente a população de células não osteogênicas do tecido mole circundante. Curiosamente, a fibrina rica em plaquetas (PRF) foi anteriormente proposta como uma membrana autóloga GBR, apesar de seu período de reabsorção em curto prazo de 2–3 semanas. Observações clínicas recentes demonstraram que, aquecendo-se uma camada de plasma pobre em plaquetas líquidas (PPP) e misturando-se a zona leucoplaquetária rica em células, as propriedades de reabsorção do gel de albumina aquecido com PRF líquida (Alb-PRF) podem ser melhoradas significativamente. Os autores realizaram um estudo com o objetivo de avaliar a reação inflamatória, a biocompatibilidade e as propriedades de degradação estendidas de uma nova membrana autóloga Alb-PRF em comparação com PRF padrão comumente utilizada após implantação em camundongos nus. Duas preparações padrão de PRF (L-PRF e H-PRF) foram comparadas ao novo Alb-PRF após implantação subcutânea em 7, 14 e 21 dias. Todos os grupos demonstraram excelente biocompatibilidade devido às suas fontes autólogas. Contudo, é importante notar que, enquanto as membranas L-PRF e H-PRF demonstraram reabsorção significativa ou completa em 21 dias, a membrana Alb-PRF permaneceu estável em volume durante todo o estudo. Este estudo demonstra uma melhora acentuada na estabilidade da membrana de Alb-PRF. Isso indica seu futuro potencial para uso como uma membrana de barreira biológica para procedimentos de GBR com meia-vida de longa duração, ou como um material de preenchimento biológico em aplicações de medicina estética. Assim, mais estudos são necessários para explorar futuras aplicações clínicas em vários campos da medicina.
De acordo com Fujioka-Kobayashi et al. (2020), a fibrina rica em plaquetas (PRF) tem sido proposta como uma membrana autóloga com as vantagens do acúmulo de plaquetas e leucócitos no hospedeiro, com aprisionamento de fatores de crescimento. No entanto, as limitações incluem suas propriedades de reabsorção mais rápida (aproximadamente 2 semanas). Curiosamente, estudos recentes têm demonstrado que, ao aquecer uma camada de plasma pobre em plaquetas (PPP), as propriedades de reabsorção de albumina aquecida (gel de albumina) podem ser estendidas de 2 semanas para mais de 4 meses (e-PRF). O estudo dos autores teve como objetivo caracterizar as propriedades biológicas desta nova modalidade regenerativa. O sangue total coletado de sangue periférico em tubos de plástico de 9 mL foi centrifugado a 700 g por 8 minutos. Depois disso, a camada de plasma pobre em plaquetas foi aquecida a 75°C durante 10 minutos, para criar albumina desnaturada (gel de albumina). As células remanescentes e fator de crescimento encontrados dentro da camada leucocitária (PRF líquido) foram posteriormente misturados novamente com o gel de albumina resfriado para formar Alb-PRF. Então, foi realizada análise histológica, incluindo a distribuição de células dentro de Alb-PRF. Sete cinéticas de liberação de fator de crescimento diferentes de Alb-PRF foram caracterizadas por até 10 dias, incluindo PDGF-AA, PDGF-AB, PDGF-BB, TGF-β1, VEGF, IGF e EGF. Posteriormente, as respostas de células de fibroblastos gengivais ao Alb-PRF foram investigadas por meio de um ensaio de vida/morte em 24 horas; ensaio de migração às 24 horas; ensaio de proliferação em 1, 3 e 5 dias; PCR em tempo real para a expressão de TGF-β e colágeno 1a2 em 3 e 7 dias; e imunocoloração do colágeno 1 em 14 dias. Foi observado pela primeira vez, histologicamente, que as células viáveis estavam distribuídas uniformemente por toda a formulação de Alb-PRF. A liberação do fator de crescimento demonstrou uma liberação lenta e gradual, particularmente para TGF-β1 e PDGF-AA / AB, durante todo o período de 10 dias. Alb-PRF também exibiu biocompatibilidade celular estatisticamente significativa maior em 24 horas e induziu maior proliferação estatisticamente significativa de fibroblastos em 5 dias, quando comparado com aqueles de controle TCP. Alb-PRF induziu ainda níveis estatisticamente significativos maiores de mRNA de TGF-β em 3 e 7 dias, bem como colágeno 1 em 7 dias. Os presentes resultados indicam que Alb-PRF possui propriedades regenerativas induzidas pela liberação lenta e gradual de fatores de crescimento encontrados em PRF líquido via degradação de gel de albumina. São necessários estudos futuros para caracterizar completamente as propriedades de degradação do Alb-PRF in vivo e explorar futuras aplicações clínicas em vários campos da medicina.
Hassan, Quinlan e Ghanem (2020) afirmam que preparações autólogas derivadas de plaquetas têm sido utilizadas em muitos campos cirúrgicos para melhorar os resultados de cicatrização, com benefícios relatados em várias indicações estéticas. Os autores elaboraram um estudo unicêntrico, prospectivo e não controlado para avaliar a eficácia da fibrina rica em plaquetas injetável (i-PRF) para o rejuvenescimento da pele facial, usando um sistema de análise de pele objetivo e medidas validadas de resultados relatados pelo paciente. Foi utilizada a tecnologia do sistema PRF® PROCESS para preparar a i-PRP. Onze indivíduos saudáveis do sexo feminino foram incluídos no estudo e durante 3 meses receberam injeções intradérmicas mensais de i-PRF em 3 regiões faciais: áreas malar (1 mL de cada lado), prega nasolabial (0,5 mL de cada lado) e pele do lábio superior acima a borda do vermelhão (1 mL). A eficácia dos procedimentos foi avaliada por uma análise objetiva da pele (VISIA®) e uma avaliação subjetiva do resultado relatado pelo paciente (FACE-Q) no início e após 3 meses. Os resultados mostraram uma melhora significativa nas manchas da superfície da pele (P = 0,01) e poros (P = 0,03) no acompanhamento de 3 meses. Outras variáveis, como textura da pele, rugas, manchas ultravioleta e porfirinas, apresentaram melhora numérica. As escalas FACE-Q, que medem a satisfação com a aparência, mostraram uma melhora significativa desde o início, incluindo satisfação com a pele (P = 0,002), satisfação com a aparência facial (P = 0,025), satisfação com as bochechas (P = 0,001), satisfação com face inferior e linha da mandíbula (P = 0,002) e satisfação com os lábios (P = 0,04). Nenhum efeito adverso importante foi relatado. Os autores concluíram que uma série de três injeções de i-PRF resultou em rejuvenescimento significativo da pele da face no acompanhamento de 3 meses, conforme demonstrado por parâmetros de análise de pele aprimorados e escores de autoavaliação do paciente.

DISCUSSÃO
Atualmente, a estética orofacial (sulco nasolabial, lábios, linhas de marionete, contorno da face, região de malar, fronte, temporal) é cada vez mais realizada pelos cirurgiões-dentistas na maioria dos países, refletindo a tendência ao uso de procedimentos menos invasivos. Os materiais de preenchimento facial, como ácido hialurônico, bioestimuladores de colágeno, PRP e IPRF, são materiais de escolha possível para esta finalidade, tanto sozinhos como unidos às técnicas cirúrgicas de rejuvenescimento facial (NACOPOULOS e VESALA, 2019). Cabe observar que Shah et al. (2017), Shashank e Bhushan (2020) e Hassan, Quinlan e Ghanem (2020) ressaltaram que a IPRF injetável é um biomaterial de segunda geração totalmente autólogo, obtido por uma baixa centrifugação do sangue.
No que se refere às vantagens do uso da PRF, Choukroun et al. (2006), Hurley et al. (2018) e Ghanaati et al. (2018) apontam uma melhor cicatrização tecidual. Além disso, Choukroun et al. (2006) mencionou, também, a cicatrização de feridas com rápido remodelamento do tecido cicatricial e ausência de qualquer processo infeccioso. Borie et al. (2015) salientaram o fato de a técnica de aplicação da IPRF ser minimamente invasiva, com baixos riscos e resultados clínicos satisfatórios. Miron et al. (2017a) e Ghanaati et al. (2018) mencionaram o controle e reparo de tecido mole; Albilia et al. (2020), por sua vez, citaram efeitos analgésicos por longo prazo na maioria dos pacientes com disfunção dolorosa de ATM.
Hurley et al. (2018) também encontraram melhoras nos níveis de dor e resultados funcionais, sendo contestados por Strauss, Stähli e Gruber (2018), que concluíram, que de acordo com os achados em seu estudo, não está claro se a IPRF pode reduzir a dor e melhorar a cicatrização dos tecidos moles.
Hassan, Quinlan e Ghanem (2020) ressaltaram ter um rejuvenescimento facial significativo, talvez pelo fato apontado por Wang et al. (2019), de uma maior capacidade de induzir a síntese da matriz de colágeno.
Adicionalmente, Wang et al. (2019) disseram que uma das principais vantagens de usar IPRF é o seu baixo custo em comparação com outros procedimentos mais invasivos, uma vez que o sangue é coletado sem o uso de anticoagulantes, sendo essa terapia totalmente autóloga. Tendo a formação de um coágulo de fibrina durante a centrifugação.
Uma das principais limitações da IPRF é sua curta taxa de renovação in vivo. Na odontologia regenerativa, fornece apenas uma capacidade limitada de agir como uma verdadeira “membrana de barreira”, uma vez que seu uso está associado a um período de reabsorção típico de 10-14 dias in vivo (FUJIOKA-KOBAYASHI et al., 2020).
CONCLUSÃO
Com a realização deste estudo, podemos concluir que as principais vantagens da IPRF são:
É um biomaterial totalmente autólogo.
Promove cicatrização de feridas em menor tempo.
Não há restrições de uso.
Baixo custo.
A IPRF tem sido utilizada com sucesso para aplicações variadas dentro da odontologia, trazendo como benefícios melhor resistência tecidual frente ao estímulo dos fatores de crescimento injetados, melhorando a microcirculação sanguínea local e a formação de colágeno. Com mais estudos sobre a biologia da PRF, no futuro podemos esperar associações com outros aditivos que irão melhorar ainda mais essa renovação do fibroblasto, levando a um envelhecimento mais lento e a um rejuvenescimento facial mais satisfatório.
REFERÊNCIAS
ALBILIA, J.B. et al. Liquid platelet-rich fibrin injections as a treatment adjunct for painful temporomandibular joints: preliminary results. Cranio®: The Journal of Craniomandibular & Sleep Practice, v. 38, n. 5, p. 292-304, 2020.
BORIE, E. et al. Platelet-rich fibrin application in dentistry: a literature review. Int J Clin Exp Med, v. 8, n. 5, p. 7922-7929, 2015.
CARUANA, A. et al. From Platelet-Rich Plasma to Advanced Platelet-Rich Fibrin: Biological Achievements and Clinical Advances in Modern Surgery. Eur J Dent., v. 13, n. 2, p. 280–286, 2019.
CHOUKROUN, J. et al. Platelet-rich fibrin (PRF): A second-generation platelet concentrate. Part IV: Clinical effects on tissue healing. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, v.101, p. E56-60, 2006.
COTRAN, R.S.; COLLINS, T.; KUMAR, V. Patologia estrutural e funcional – Robbins. 6.ed., São Paulo: Guanabara Koogan, 2000.
FUJIOKA-KOBAYASHI, M. et al. Biological characterization of an injectable platelet-rich fibrin mixture consisting of autologous albumin gel and liquid platelet-rich fibrin (Alb-PRF). Platelets, Early Online, p. 1–8, 2020.
GENTILE, D. Easy Platelet-Rich Fibrin (Injectable/Topical) for Post-resurfacing and Microneedle Therapy. Facial Plast Surg Clin N Am, v. 28, p. 127–134, 2020.
GHANAATI, S. et al. Fifteen Years of Platelet Rich Fibrin in Dentistry and Oromaxillofacial Surgery: How High is the Level of Scientific Evidence? Journal of Oral Implantology, v. 44, n. 6, p. 471-492, 2018.
GHENO, E. et al. In vivo evaluation of the biocompatibility and biodegradation of a new denatured plasma membrane combined with liquid PRF (Alb-PRF). Platelets, Early Online, p. 1–13, 2020.
HASSAN, H.; QUINLAN, D.J.; GHANEM, A. Injectable platelet-rich fibrin for facial rejuvenation: A prospective, single-center study. Journal of Cosmetic Dermatology, v. 19, n.12, p. 1-9, 2020.
HOFNY, E.R.M. Increased expression of TGF-β protein in the lesional skins of melasma patients following treatment with platelet-rich plasma. Journal of Cosmetic and Laser Therapy, v. 21, n. 7-8, p. 382-389, 2019.
HURLEY, E.T. et al. The Efficacy of Platelet-Rich Plasma and Platelet-Rich Fibrin in Arthroscopic Rotator Cuff Repair. A Meta-analysis of Randomized Controlled Trials. AJSM, v. 20, n. 10, p. 1-7, 2018.
KAWASE, T; TANAKA, T. An updated proposal for terminology and classification of platelet-rich fibrin. Regen. Ther., v. 7, p. 80-81, 2017.
KEYHAN, S.O. et al. Use of platelet-rich fibrin and platelet-rich plasma in combination with fat graft: which is more effective during facial lipostructure? J Oral Maxillofac Surg., v. 71, n. 3, p. 610-21, 2013.
LIANG, Z.J. et al. Precise Intradermal Injection of Nanofat Derived Stromal Cells Combined with Platelet-Rich Fibrin Improves the Efficacy of Facial Skin Rejuvenation. Cell Physiol Biochem, v. 47, p. 316-329, 2018.
LIN, J.; SCLAFANI, A.P. Platelet-Rich Plasma for Skin Rejuvenation and Tissue Fill. Facial Plastic Surgery Clinics of North America, v. 26, n. 4, p. 439-446, 2018.
MIRON, R.J. et al. Use of platelet-rich fibrin in regenerative dentistry: a systematic review. Clin Oral Invest, v. 21, p. 1913–1927, 2017a.
MIRON, R.J. et al. Injectable platelet rich fibrin (i-PRF): opportunities in regenerative dentistry? Clinical Oral Investigations, v. 21, n. 8, p. 2619–2627, 2017b.
MOHAN, S.P. Platelet-Rich Plasma and Platelet-Rich Fibrin in Periodontal Regeneration: A Review. J Pharm Bioallied Sci., v. 11, sup. 2, p. S126–S130, 2019.
MOREIRA, V.; NOGUEIRA, F.N.N. Do indesejável ao inevitável: a experiência vivida do estigma de envelhecer na contemporaneidade. Psicologia USP, v. 19, n. 1, p. 59-79, 2008.
NACOPOULOS, C.; VESALA, A.M. Lower facial regeneration with a combination of platelet‐rich fibrin liquid matrices based on the low speed centrifugation concept‐Cleopatra technique. J Cosmet Dermatol., v. 19, n. 1, p. 185-189, 2019.
SANTOS, L.; ZOBOLI, F.; CORREIA, E. Estética/beleza e antienvelhecimento feminino: biotecnologia e potencialização do corpo. Praxia - Revista on-line de Educação Física da UEG, v. 1, n. 4, p. 48-61, 2013.
SCLAFANI, A.P. Safety, efficacy, and utility of platelet-rich fibrin matrix in facial plastic surgery. Arch Facial Plast Surg., v. 13, n. 4, p. 247-51, 2011.
SCLAFANI, A.P.; McCORMICK, S.A. Induction of dermal collagenesis, angiogenesis, and adipogenesis in human skin by injection of platelet-rich fibrin matrix. Arch Facial Plast Surg., v. 14, n.2, p. 132-6, 2012.
SHAH, R. et al. An Update on the Protocols and Biologic Actions of Platelet Rich Fibrin in Dentistry. European Journal of Prosthodontics and Restorative Dentistry, v. 25, p. 64–72, 2017.
SHASHANK, B.; BHUSHAN, M. Injectable Platelet‐Rich Fibrin (PRF): The newest biomaterial and its use in various dermatological conditions in our practice: A case series. J Cosmet Dermatol., p. 1–6, 2020.
STRAUSS, F.J.; STÄHLI, A; GRUBER, R. The use of platelet‐rich fibrin to enhance the outcomes of implant therapy: A systematic review. Clin Oral Impl Res., v. 29, suppl. 18, p. 6–19, 2018.
ULUSAL, B.G. Platelet-rich plasma and hyaluronic acid – an efficient biostimulation method for face rejuvenation. Journal of Cosmetic Dermatology, v. 0, p. 1-8, 2016.
VERMA, U.P. et al. Platelet-rich Fibrin: A Paradigm in Periodontal Therapy – A Systematic Review. J Int Soc Prev Community Dent., v. 7, n. 5, p. 227–233, 2017.
WANG, X. et al. Fluid platelet‐rich fibrin stimulates greater dermal skin fibroblast cell migration, proliferation, and collagen synthesis when compared to platelet‐rich plasma. Journal of Cosmetic Dermatology, p. 1-7, 2019.
Downloads


