O Impacto da Disbiose da Microbiota Oral e da Resposta Imunológica nos Problemas de Implantes Dentários
A implantodontia é uma das áreas mais dinâmicas da odontologia, porém, apesar dos avanços no conhecimento clínico e nas novas tecnologias, ainda está associada a muitas complicações que podem levar à perda do implante ou ao desenvolvimento de doenças, como a peri-implantite. Uma das razões pode ser a incapacidade dos implantes de obter uma osseointegração adequada devido à disbiose da microbiota oral e à inflamação associada, causada por desequilíbrio imunológico. Este estudo visa apresentar o conhecimento atual sobre o impacto da disbiose da microflora oral e da desregulação do sistema imunológico no curso das falhas observadas na implantodontia.
A Diversidade da Microbiota Oral e sua Interação com o Sistema Imunológico
A microflora oral inclui um sistema altamente diverso e complexo de bactérias, microeucariotos, archaea e vírus. Esses microrganismos habitam diferentes nichos na cavidade oral, como dentes, sulco gengival, língua, bochechas e tonsilas, cada um fornecendo um ambiente único que influencia a colonização e o crescimento microbiano.
Essa diversidade não é apenas inerente à saúde bucal, mas também desempenha um papel fundamental na conformação do metabolismo local devido aos diferentes microambientes presentes na cavidade oral. A natureza dinâmica dessas comunidades microbianas está ligada ao desenvolvimento de doenças dentárias comuns, como cárie e periodontite, destacando o impacto direto dos micróbios orais na saúde humana.
O estado do sistema imunológico do hospedeiro e a diversidade de bactérias dentro da microbiota oral estão fortemente correlacionados. A interação entre a microbiota oral e o sistema imunológico parece ser um processo dinâmico envolvendo mecanismos imunes inatos e adaptativos. Uma interação equilibrada entre a microbiota e o sistema imunológico é essencial para a iniciação, modulação e cessação adequadas das respostas imunes.
Muitos microrganismos orais estabelecem biofilmes, que são assembleias organizadas de micróbios anexados a superfícies e envoltos em uma matriz extracelular protetora. Os biofilmes são uma parte natural do microbioma oral, mas podem contribuir para processos de doenças se microrganismos patogênicos dominarem. Eles fornecem um ambiente estável para a complexa comunidade de microrganismos na cavidade oral. Essa matriz protetora protege as bactérias do estresse ambiental e permite a manutenção de um ecossistema equilibrado.
A composição variada da microflora bacteriana em diferentes regiões da cavidade oral é aparente, influenciando a eficácia e a segurança de vários aparelhos odontológicos utilizados. Isso é particularmente verdadeiro no contexto de implantes dentários e outros materiais odontológicos, quando a variedade de bactérias e sua adaptação específica ao ambiente oral ressaltam a necessidade de adaptação dos métodos antibacterianos a tipos específicos de dispositivos. Portanto, deve-se considerar que diferentes áreas da cavidade oral, devido às suas condições únicas, podem favorecer o desenvolvimento de espécies específicas de microrganismos, o que requer uma abordagem individual em termos de prevenção e tratamento.
O Papel Crítico do Sistema Imunológico no Processo de Osseointegração dos Implantes Dentários
O sistema imunológico desempenha um papel fundamental no processo de osseointegração em implantes dentários. A osseointegração é um equilíbrio de longo prazo entre as células imunes do hospedeiro e os biomateriais ósseos. O papel do sistema imunológico nesse processo se concentra principalmente em 5 aspectos-chave:
Promoção da cicatrização: Após a implantação, o sistema imunológico facilita a cicatrização de feridas no local da implantação.
Prevenção de infecções: Ajuda a prevenir infecções potenciais que poderiam interferir no processo de osseointegração.
Regulação da inflamação: A inflamação controlada é essencial para a osseointegração, mas a inflamação excessiva pode levar à falha do implante.
Suporte à remodelação óssea: Células imunes, como macrófagos e osteoclastos, estão envolvidas na remodelação óssea, que é necessária para a integração do implante com o osso existente.
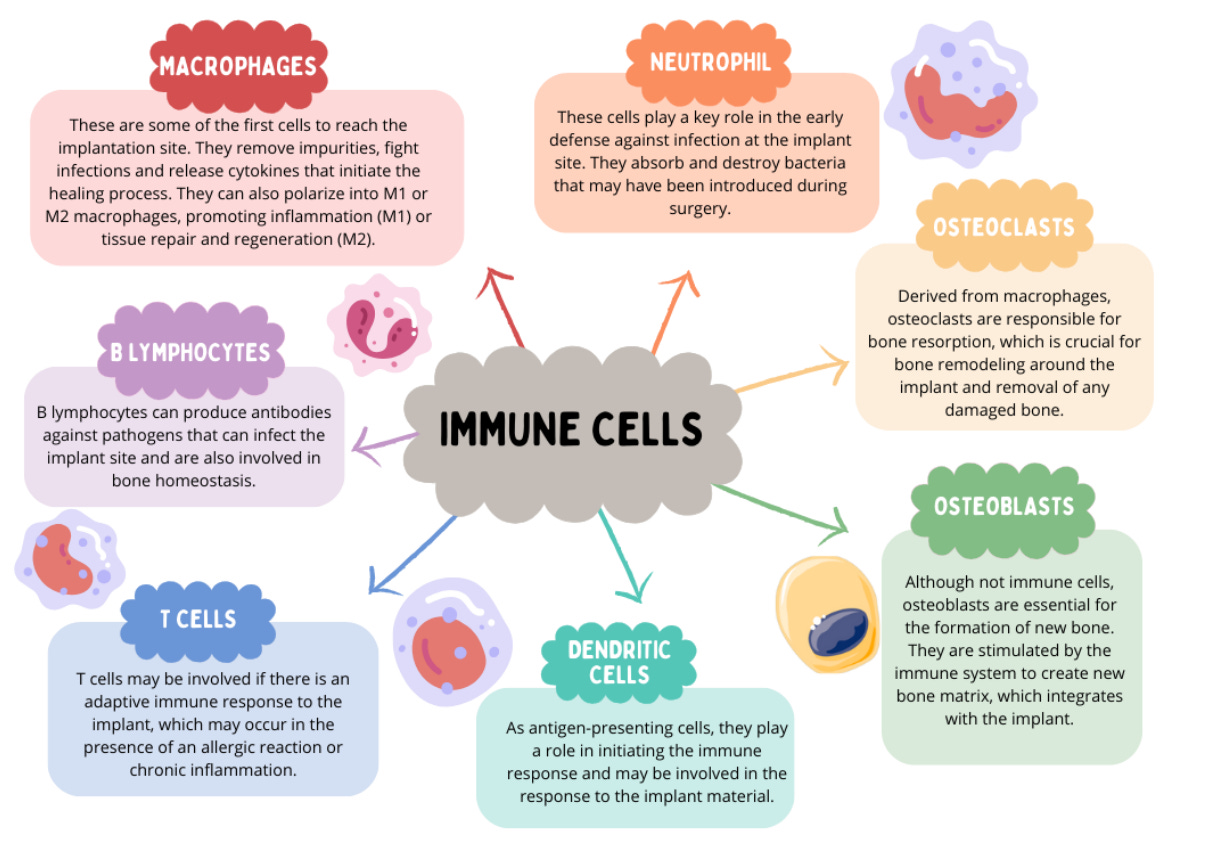
O sistema imunológico desempenha um papel crucial na manutenção da homeostase, regulando o equilíbrio entre a formação e a reabsorção óssea, um fator fundamental para a estabilidade do implante. Inúmeras células imunes estão engajadas nesses processos, incluindo macrófagos, neutrófilos, osteoclastos, osteoblastos, células dendríticas, bem como linfócitos T e B.
TLRs são receptores-chave do sistema imunológico inato que reconhecem padrões moleculares associados a patógenos e desempenham um papel crucial na iniciação e regulação das respostas imunes, atuam…
1. Mediando Respostas Inflamatórias
TLRs podem iniciar e modular respostas inflamatórias reconhecendo padrões específicos associados a componentes microbianos, que podem ser cruciais na defesa contra micróbios patogênicos.
2. Mantendo a Homeostase do Tecido Oral
A presença constante de micróbios comensais na cavidade oral requer um sistema para manter a homeostase, e TLRs contribuem para isso regulando a expressão de genes envolvidos nas respostas imunes nos tecidos da mucosa da cavidade oral.
3. Detectando a Microbiota e Acionando Respostas Imunes
TLRs são fundamentais para detectar a microbiota oral, distinguindo entre organismos comensais e patógenos potenciais, e ativando respostas imunes apropriadas. Eles podem induzir tolerância a comensais ou ativar a imunidade ao encontrar patógenos.
4. Influenciando o Equilíbrio do Microbioma Oral
O equilíbrio do microbioma oral entre a promoção da saúde e a disbiose, causando bactérias, é crítico. Disbiose, ou o desequilíbrio desse microbioma, pode levar a problemas dentários comuns como periodontite e cáries, com os TLRs desempenhando um papel significativo na resposta do hospedeiro a essas mudanças.
5. Reconhecimento de Padrões e Ativação Imune
Como receptores de reconhecimento de padrões, os TLRs se ligam a componentes microbianos para ativar as defesas imunológicas inatas do corpo e modular o sistema imunológico adaptativo, preparando-o para responder a várias ameaças imunológicas.
Os macrófagos têm uma posição central na homeostase óssea e na integração do osso com biomateriais nas proximidades dos implantes dentários. Quando objetos estranhos, como implantes dentários, são introduzidos nos tecidos, os macrófagos cumprem uma função dupla, iniciando uma resposta inflamatória (macrófagos M1) ou uma resposta anti-inflamatória (macrófagos M2). A presença de macrófagos M2 no tecido peri-implante está ligada à diminuição da inflamação, melhora da cicatrização de feridas e, finalmente, à integração bem-sucedida dos implantes no osso.
A osseointegração, um processo crítico para o sucesso a longo prazo dos implantes, é essencial para a estabilidade do implante e é considerada um pré-requisito para o carregamento e o sucesso clínico prolongado dos implantes dentários no tecido ósseo. A interface implante-tecido é uma região altamente dinâmica. A resposta do sistema imunológico e a inflamação exigem processos bioquímicos ativos para restaurar a homeostase, facilitando, em última análise, a osseointegração do implante. A osseointegração inadequada e a inflamação persistente são os dois principais fatores subjacentes ao desenvolvimento da peri-implantite.
Tipos de Complicações Observadas na Implantodontia e Etiologia das Falhas Dentárias
O uso de implantes dentários é atualmente um método confiável para tratar o edentulismo, com uma taxa de sucesso de 97% após 10 anos e 75% após 20 anos. No entanto, como em qualquer procedimento, podem surgir complicações que podem resultar na perda do implante. A falha do implante pode ser categorizada em estágios iniciais (<3 meses) e tardios (>3 meses).
A falha precoce do implante pode ser causada por fatores como aquecimento excessivo do osso durante a perfuração, superpreparação do local cirúrgico ou osso de baixa densidade que dificulta a estabilidade inicial do implante. Por outro lado, as falhas tardias dos implantes estão tipicamente associadas a infecções, sendo a peri-implantite a mais comum.
Os riscos associados à falha do implante dentário são muito debatidos entre os clínicos a fim de evitar complicações relacionadas ao implante. Com avanços significativos na ciência dos materiais e nas técnicas cirúrgicas, há um foco crescente nos fatores relacionados ao paciente como potenciais fatores de risco para falha do implante dentário.
Pacientes que foram expostos à radiação antes ou após a implantação, bem como aqueles com diabetes grave ou histórico de tabagismo, enfrentam um risco significativamente elevado de falha do implante dentário. Essas condições podem comprometer a sobrevivência do implante, aumentando a vulnerabilidade do paciente a outras doenças ou interferindo na cicatrização dos tecidos.
O histórico odontológico do paciente, especialmente um histórico de periodontite, destaca-se como um fator de risco crítico para a eventual falha dos implantes dentários. A periodontite, uma das principais causas de perda dentária, exige o uso de implantes para reabilitação oral. A periodontite prévia é frequentemente vista como um indicador de peri-implantite potencial, o que pode resultar na falha tardia do implante.
Macrófagos
Essas são algumas das primeiras células a alcançar o local do implante. Eles removem impurezas, combatem infecções e liberam citocinas que iniciam o processo de cicatrização. Eles também podem se polarizar em M1 ou M2, promovendo inflamação (M1) ou reparo tecidual e regeneração (M2).
Neutrófilos
Essas células desempenham um papel fundamental na defesa inicial contra infecções no local do implante. Eles absorvem e destroem bactérias que podem ter sido introduzidas durante a cirurgia.
Osteoclastos
Derivados de macrófagos, os osteoclastos são responsáveis pela reabsorção óssea, que é crucial para a remodelação óssea ao redor do implante e a remoção de qualquer osso danificado.
Linfócitos B
Linfócitos B podem produzir anticorpos contra patógenos que podem infectar o local do implante e também estão envolvidos na homeostase óssea.
Células T
As células T podem estar envolvidas se houver uma resposta imune adaptativa ao implante, o que pode ocorrer na presença de uma reação alérgica ou inflamação crônica.
Células Imunes
Células Dendríticas Como células apresentadoras de antígenos, elas desempenham um papel na iniciação da resposta imune e podem estar envolvidas na resposta ao material do implante.
Osteoblastos
Embora não sejam células imunes, os osteoblastos são essenciais para a formação de novo osso. Eles são estimulados pelo sistema imunológico a criar uma nova matriz óssea, que se integra ao implante.
O Papel da Microbiota Oral e do Sistema Imunológico no Curso da Peri-implantite
A peri-implantite é uma doença destrutiva e inflamatória que afeta os tecidos duros e moles ao redor dos implantes osseointegrados. É caracterizada por dano progressivo ao osso alveolar. A mucosite ocorre em aproximadamente 80% dos pacientes com implantes dentários. No entanto, a incidência de peri-implantite varia de 28% a 56% entre os pacientes e de 12% a 43% entre os implantes.
A microbiota oral é notavelmente diversa, compreendendo mais de 700 espécies distintas, com um indivíduo normalmente abrigando pelo menos 100 tipos diferentes dentro de sua boca. Alterações no ambiente oral podem levar a uma mudança na composição microbiana do biofilme, permitindo potencialmente que certas espécies bacterianas proliferem, aumentem seu potencial patogênico e se tornem oportunistas.
O início da peri-implantite é marcado pelo surgimento de bactérias gram-negativas, móveis e anaeróbias, que também são conhecidas por serem prevalentes na periodontite. Vários micróbios foram identificados em casos de peri-implantite, incluindo Staphylococcus aureus, Staphylococcus epidermidis, Enterobacter aerogenes, Enterobacter cloacae, Escherichia coli, Helicobacter pylori, espécies de Pseudomonas e espécies de Candida.
Danos aos tecidos peri-implantares desencadeiam uma resposta inflamatória envolvendo a ativação de células imunes inatas, como macrófagos, células dendríticas, mastócitos e neutrófilos. Os neutrófilos desempenham um papel na promoção da liberação de citocinas pró-inflamatórias, incluindo IL-1 e TNF-α. Essas citocinas, por sua vez, contribuem para os danos teciduais osteolíticos e inflamatórios característicos da peri-implantite.
Métodos de Prevenção de Falhas na Implantodontia
Modificações nas propriedades físico-químicas dos implantes dentários desempenham um papel na diminuição da adesão de microrganismos à superfície do implante. Isso tem um impacto benéfico na redução do risco de iniciar o processo de peri-implantite, embora não possa erradicá-lo completamente. As características dos materiais dentários influenciam não apenas a quantidade de microrganismos, mas também sua composição e quão fortemente eles aderem à superfície do material.
Hidrogéis são empregados para modificar materiais dentários com o objetivo de aprimorar suas propriedades antibacterianas. Esses hidrogéis são polímeros hidratados conhecidos por sua notável versatilidade terapêutica, especificamente projetados para uso humano. Esses biomateriais criam uma rede robusta de moléculas naturais ou sintéticas capazes de encapsular agentes terapêuticos dentro de sua estrutura interna. Eles demonstraram funcionar efetivamente como um revestimento em implantes de titânio sem causar uma reação inflamatória.
A radiação ultravioleta (UV) também tem sido empregada na modificação de materiais dentários. As superfícies dos implantes expostas à radiação UV exibem maior bioatividade e maior potencial de osseointegração. Essa transformação é atribuída a alterações na camada superficial do dióxido de titânio. Além disso, a radiação UV aprimora a osteocondutividade, facilitando as interações entre células e proteínas com a superfície do implante.
As taxas atuais de resistência a antibióticos relacionadas à disbiose da microbiota causada pelo uso generalizado de antibióticos e antissépticos levaram à sugestão de probióticos como uma opção de tratamento para peri-implantite. Os probióticos são definidos como microrganismos vivos que, quando administrados em quantidades apropriadas, fornecem benefícios promotores da saúde ao corpo. Eles são considerados seguros e benéficos devido à sua capacidade de reduzir as propriedades imunogênicas da microbiota, promovendo um equilíbrio microbiano mais favorável no hospedeiro e suprimindo efetivamente patógenos nocivos.
Os hábitos alimentares dos pacientes desempenham um papel fundamental na prevenção ou tratamento de várias doenças, incluindo o processo de osseointegração dos implantes dentários. Vários micronutrientes, como cálcio, flúor, magnésio, potássio, vitamina B6, vitamina D e zinco, demonstraram seu impacto positivo na saúde óssea, reduzindo o risco de fraturas. Por outro lado, dietas ricas em gorduras, carboidratos, colesterol e baixas em cálcio têm efeitos adversos no osso da mandíbula.
Conclusão
A implantodontia é uma área em desenvolvimento dinâmico na odontologia que aborda o problema da perda dentária, o que reduz a qualidade de vida dos pacientes. Analisando as estatísticas globais, pode-se notar que tanto os clínicos quanto os pacientes estão cada vez mais interessados nesse método de tratamento devido à garantia de conforto de vida e estética apropriada. Embora a implantodontia seja em grande parte bem-sucedida para a maioria dos pacientes, deve-se lembrar que uma complicação como a peri-implantite ainda é uma condição grave que não foi eliminada e pode levar à perda do implante dentário.
É por isso que é tão importante entender a natureza da microflora oral normal e seu impacto no sistema imunológico. Um desequilíbrio na composição dos microrganismos que colonizam a cavidade oral leva a distúrbios no sistema imunológico, o que pode se manifestar como inflamação. Entender como é importante manter a higiene bucal é um passo revolucionário que poderia reduzir a ocorrência ou progressão de muitas doenças sistêmicas. Graças ao desenvolvimento de pesquisas, os cientistas puderam fornecer aos clínicos informações mais relevantes sobre a influência da microflora oral na osseointegração bem-sucedida dos implantes.
É fundamental buscar constantemente o desenvolvimento de novos métodos relacionados à modificação de materiais dentários. Mudanças e melhorias nesses materiais também são um fator importante que poderia inibir a colonização de patógenos na superfície dos implantes dentários, o que poderia reduzir a incidência de peri-implantite.
Referências:
Insua, A., Monje, A., Wang, H.-L., & Miron, R.J. (2017). Basis of Bone Metabolism around Dental Implants during Osseointegration and Peri-Implant Bone Loss. Journal of Biomedical Materials Research Part A, 105(7), 2075–2089.
Dhaliwal, J.S., Rahman, N.A., Ming, L.C., Dhaliwal, S.K.S., Knights, J., & Albuquerque Junior, R.F. (2021). Microbial Biofilm Decontamination on Dental Implant Surfaces: A Mini Review. Frontiers in Cellular and Infection Microbiology, 11, 736186.
Alves, C.H., Russi, K.L., Rocha, N.C., Bastos, F., Darrieux, M., Parisotto, T.M., & Girardello, R. (2022). Host-Microbiome Interactions Regarding Periimplantitis and Dental Implant Loss. Journal of Translational Medicine, 20(1), 425.
Flichy-Fernández, A.J., Ata-Ali, J., Alegre-Domingo, T., Candel-Martí, E., Ata-Ali, F., Palacio, J.R., & Peñarrocha-Diago, M. (2015). The Effect of Orally Administered Probiotic Lactobacillus Reuteri-Containing Tablets in Peri-Implant Mucositis: A Double-Blind Randomized Controlled Trial. Journal of Periodontal Research, 50(6), 775–785.
Kligman, S., Ren, Z., Chung, C.-H., Perillo, M.A., Chang, Y.-C., Koo, H., Zheng, Z., & Li, C. (2021). The Impact of Dental Implant Surface Modifications on Osseointegration and Biofilm Formation. Journal of Clinical Medicine, 10(8), 1641.